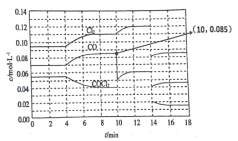
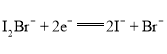题目内容
【题目】有下列离子晶体立体构型示意图如下图所示。

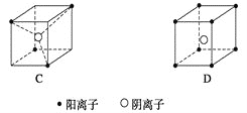
(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
【答案】MN MN2 MN2 MN 离子键、非极性共价键 ![]()
【解析】
(1)对于A,阴离子位于立方体4个顶点,因此阴离子在该立方体内只有4×1/8=1/2 (个),同理阳离子也只有1/2个,组成上为1/2∶1/2=1∶1,表达式为MN;对于B,阴离子在立方体内有4×1/2+2=4(个),阳离子在立方体内有8×1/8+1=2(个),组成为MN2;对于C,阴离子在立方体内有1个,阳离子在立方体内有4×1/8=1/2(个),组成为MN2;对于D,阴离子在立方体内有1个,阳离子在立方体内有8×1/8=1(个),组成为MN。答案:MN、 MN2、 MN2、 MN 。
(2)FeS2晶体中的化学键为离子键和硫硫之间的非极性共价键。密度ρ=m/V,由立方体内阴、阳离子个数和摩尔质量可求出m,而由立方体的边长即阴、阳离子间的距离可求出立方体体积。ρ=(1/2![]() g
g![]() mol-1)=NAmol-1
mol-1)=NAmol-1![]() a3cm3g·cm-3=
a3cm3g·cm-3=![]() 。答案:离子键、非极性共价键 、
。答案:离子键、非极性共价键 、 ![]()

【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
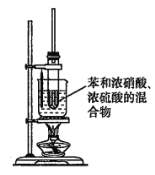
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。