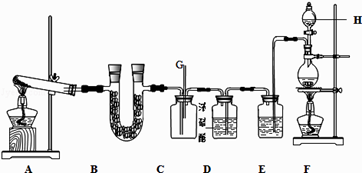
��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺
���� ���ڡ� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
1 | �� | ||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� | �� |
��1�����ԭ�ӽṹʾ��ͼΪ________________________________��
��2���ں͢���̬�⻯���ȶ��ԵĴ�С˳��___________(�ѧʽ)��
��3���ۢ�����ۺ������������ǿ����__________(�ѧʽ)��
��4���۵���̬�⻯����۵�����������Ӧ��ˮ���ﷴӦ���ɵ�����________(�ѧʽ)��������________(�������ۻ��������������ӻ�������)��
��5���٢ܢ�����Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1��1��1�Ĺ��ۻ�������ĵ���ʽΪ________��
��6�����ȽϢܺ͢�����Ԫ�صķǽ�����ǿ����������Ϊ��֤��֤����________(����ĸ)��
A���Ƚ�������Ԫ�ص��ʵķе�
B���Ƚ�������Ԫ�ص������������ϵ�����
C���Ƚ�������Ԫ�ص�����������Ӧˮ����������
D���Ƚ�������Ԫ�ص��������Ӧ��������
���𰸡�  NH3>CH4 HClO4 NH4NO3 ���ӻ�����
NH3>CH4 HClO4 NH4NO3 ���ӻ����� ![]() B
B
������������Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��C��N��O��Na��Mg��Al��P��S��Cl��
��1��P��ԭ�ӽṹʾ��ͼΪ��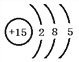 ����2���ں͢�����ͬ���ڣ��������ҷǽ�������ǿ������̬�⻯���ȶ��Դ�С˳����NH3��CH4����3���ۡ��ࡢ��ķǽ�������ǿ����Cl������ۺ������������ǿ����HClO4����4���۵���̬�⻯���ǰ������۵�����������Ӧ��ˮ���������ᣬ���߷�Ӧ����ʽNH3+HNO3=NH4NO3��������������ӻ������5���١��ܡ�������Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1:1:1�Ĺ��ۻ�������HClO������ʽΪ
����2���ں͢�����ͬ���ڣ��������ҷǽ�������ǿ������̬�⻯���ȶ��Դ�С˳����NH3��CH4����3���ۡ��ࡢ��ķǽ�������ǿ����Cl������ۺ������������ǿ����HClO4����4���۵���̬�⻯���ǰ������۵�����������Ӧ��ˮ���������ᣬ���߷�Ӧ����ʽNH3+HNO3=NH4NO3��������������ӻ������5���١��ܡ�������Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1:1:1�Ĺ��ۻ�������HClO������ʽΪ![]() ����6��A��Ԫ�ص��ʵķе㲻�������ȽϷǽ�����ǿ����A����B��Ԫ�ص�������������Խ���ף��ǽ�����Խǿ��B��ȷ��C����Ԫ��û�����������ˮ���C����D��Ԫ�ص��������Ӧ�������ԣ����������ȽϷǽ�����ǿ����D����ѡB��
����6��A��Ԫ�ص��ʵķе㲻�������ȽϷǽ�����ǿ����A����B��Ԫ�ص�������������Խ���ף��ǽ�����Խǿ��B��ȷ��C����Ԫ��û�����������ˮ���C����D��Ԫ�ص��������Ӧ�������ԣ����������ȽϷǽ�����ǿ����D����ѡB��