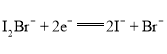��Ŀ����
����Ŀ���������ҹ���ѧ�ҷ�����һϵ�������ش����ϵ�������ϣ�����һ��ΪFeSmAsFO��ɵĻ�����ش��������⣺
��1��Ԫ��As��Nͬ�塣Ԥ��As���⻯����ӵ�����ṹΪ_______����е��NH3��_______�������������������������ж�������_________________________��
��2��Fe��Ϊ������ʱ����ʧȥ______������ӣ�Sm�ļ۲�����Ų�ʽΪ4f66s2��Sm3+�ļ۲�����Ų�ʽΪ______________________��
��3���Ƚ����Ӱ뾶��F__________O2����������������������С��������
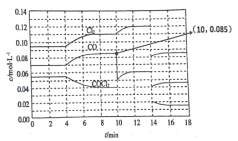
��4��һ���ķ��ṹ�ij���������ľ����ṹ��ͼ1��ʾ��������Sm��Asԭ�ӵ�ͶӰλ����ͼ2��ʾ��
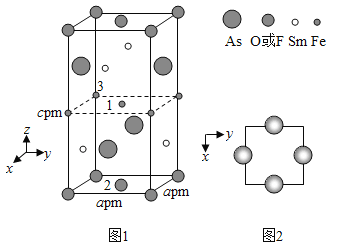
ͼ��F��O2��ͬռ�ݾ��������µ���λ�ã������ߵı���������x��1x��������û�����Ļ�ѧʽ��ʾΪ____________��ͨ���ⶨ�ܶ����;������������Լ�������ʵ�xֵ��������ǹ�ϵ����ʽ����=________g��cm3��
�Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã�����ԭ�ӷ������꣬����ͼ1��ԭ��1������Ϊ(![]() )����ԭ��2��3������ֱ�Ϊ__________��__________��
)����ԭ��2��3������ֱ�Ϊ__________��__________��
���𰸡������� �� NH3���Ӽ������� 4s 4f5 С�� SmFeAsO1xFx ![]()
![]()
![]()
��������
��1��As��Nͬ�壬��AsH3���ӵ�����ṹ������NH3��Ϊ�����Σ�����NH3���Ӽ�������ʹ�е����ߣ���AsH3�ķе��NH3�ͣ�
�ʴ�Ϊ�������Σ��ͣ�NH3���Ӽ���������
��2��FeΪ26��Ԫ�أ�Feԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2��Feԭ��ʧȥ1������ʹ4s���Ϊ�����״̬�������ϵͣ�������ʧȥ4s������ӣ�Sm�ļ۵����Ų�ʽΪ4f66s2��ʧȥ3�����ӱ��Sm3+��Ϊ�ȶ�״̬����Ӧ��ʧȥ�����ϸߵ�4s���ӣ�����Sm3+�ļ۵����Ų�ʽΪΪ4f5��
�ʴ�Ϊ��4s��4f5��
��3��F-��O2-�ĺ�������Ų���ͬ���˵����Խ����뾶ԽС���ʰ뾶��F-<O2-��
�ʴ�Ϊ��<��
��4����ͼ1��֪��ÿ�������к�Smԭ�ӣ�4![]() =2����Feԭ�ӣ�4
=2����Feԭ�ӣ�4![]() +1=2����Asԭ�ӣ�4
+1=2����Asԭ�ӣ�4![]() =2����Oԭ�ӣ���8
=2����Oԭ�ӣ���8![]() +2
+2![]() ����1-x��=2��1-x������Fԭ�ӣ���8
����1-x��=2��1-x������Fԭ�ӣ���8![]() +2
+2![]() ��x=2x�����Ըû�����Ļ�ѧʽΪSmFeAsO1-xFx��
��x=2x�����Ըû�����Ļ�ѧʽΪSmFeAsO1-xFx��
���ݸû�����Ļ�ѧʽΪSmFeAsO1-xFx��һ������������Ϊ ��һ�����������Ϊa2c
��һ�����������Ϊa2c![]() 10-30cm3�����ܶ�
10-30cm3�����ܶ�![]() =
=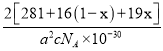 g/cm3��
g/cm3��
�ʴ�Ϊ��SmFeAsO1-xFx��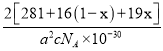 ��
��
����ԭ��1�����꣨![]() ��
��![]() ��
��![]() ������֪ԭ��2��3������ֱ�Ϊ��
������֪ԭ��2��3������ֱ�Ϊ��![]() ��
��![]() ��0������0��0��
��0������0��0��![]() ����
����
�ʴ�Ϊ����![]() ��
��![]() ��0������0��0��
��0������0��0��![]() ����
����