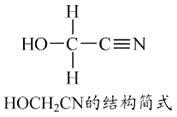
题目内容
【题目】用海水制盐工业中的母液来生产金属镁的一种工艺流程如下下列说法错误的是

A. 上述工艺流程中未涉及置换反应
B. 设计步骤①、②、③的主要目的是富集MgCl2
C. 脱水时在HCl气氛中进行可抑制MgCl2水解
D. 电解得到的炽热镁粉可在氮气中冷却
【答案】D
【解析】
由流程可知,CaO与水反应生成氢氧化钙,与母液中镁离子反应生成氢氧化镁,过滤分离出Mg(OH)2,Mg(OH)2与HCl发生复分解反应生成MgCl2,在HCl在气流中蒸发结晶得到无水MgCl2,HCl存在抑制了镁离子的水解,最后电解熔融MgCl2冶炼Mg,据此解答。
A.由上述分析可知,涉及化合反应、复分解反应、分解反应,不涉及置换反应, A正确;
B.海水中Mg2+浓度较小,步骤①、②、③的主要目的是富集MgCl2,B正确;
C.MgCl2是强酸弱碱盐,在溶液中Mg2+水解产生Mg(OH)2和HCl,且生成盐酸易挥发,脱水时在HCl气氛中进行可防止MgCl2发生水解,C正确;
D.Mg为活泼金属,且Mg与二氧化碳反应生成MgO和C单质,因此电解熔融氯化镁冶炼Mg,产生的Mg蒸气不能在二氧化碳气氛中冷却,,要在惰性气体中冷却,D错误;
故合理选项是D。

【题目】除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) ![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为________;
② 下列能增大碳的转化率的措施是________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。
(3)合成气合成甲醇的主要反应是:2H2(g)+CO(g) ![]() CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。
② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是____________。
(5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。