题目内容
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
【答案】B
【解析】
试题A、C是固体,浓度视为常数,不能写入平衡常数表达式,故错误;B、B的转化率为1.6×2/(4×2)×100%=40%,故正确;C、化学平衡常数只受温度的影响,温度不变,平衡常数不变,故错误;D、增加B,虽然平衡右移,但B的总量也增加,B的转化率降低,故错误。

【题目】化学反应速率与限度与生产、生活密切相关
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大___________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率______________。(设溶液体积不变)
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_________。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

①该反应的化学方程式是__________________________。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
A.X、Y、Z的反应速率相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为_____________________。
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
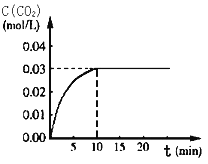
(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
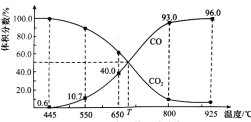
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。