题目内容
11.下列反应的离子方程式中,书写正确的是( )| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
分析 A.一水合氨在离子反应中保留化学式,反应生成氢氧化铝和硫酸铵;
B.电解生成NaOH、氢气、氯气;
C.反应生成氯化钙、水、二氧化碳;
D.发生氧化还原反应生成硫酸铁、水,电子、电荷不守恒.
解答 解:A.Al2(SO4)3 溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A错误;
B.电解饱和食盐水的离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,故B正确;
C.碳酸钙与盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故C正确;
D.FeSO4 溶液中加入用硫酸酸化的H2O2溶液的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,故D错误;
故选BC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
请回答:
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
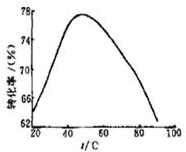
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.

①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
2.用铝还原下列化合物,制得金属各1mol,消耗铝最少的是( )
| A. | MnO2 | B. | WO3 | C. | Co3O4 | D. | Cr2O3 |
19.已知Mg(OH)2的溶度积Ksp=1.8×10-11mol3.L-3,则其饱和溶液中的pH为( )
| A. | 3.48 | B. | 3.78 | C. | 10.52 | D. | 10.22 |
3.分别向含有下列离子的溶液中加入NaOH固体(溶液体积不变),能引起离子浓度减少的是( )
| A. | Cl- | B. | OH- | C. | [Al(OH)4]- | D. | HCO3- |
20.在一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 单位时间内生成n mol的A2,同时生成n mol的AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol的AB同时生成n mol的B2 | |
| D. | 平均相对分子质量不随时间变化而变化 |
