题目内容
20.在一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )| A. | 单位时间内生成n mol的A2,同时生成n mol的AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol的AB同时生成n mol的B2 | |
| D. | 平均相对分子质量不随时间变化而变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、速率之比不等于对应物质的化学计量数之比,故A错误;
B、两边的气体计量数相等,容器内压强始终保持不变,不能说明达平衡状态,故B错误;
C、单位时间内生成2n mol的AB等效于消耗n mol的B2同时生成n mol的B2,说明达平衡状态,故C正确;
D、根据质量守恒,总质量始终不变,总物质的量始终相等,所以平均相对分子质量始终不随时间变化而变化,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
10.在密闭容器中可逆反应aA(气)+bB(气)?cC(气)+dD(气),△H=Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是( )
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |
11.下列反应的离子方程式中,书写正确的是( )
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
15.食盐中加有KIO3,KIO3在工业上以石墨和铁为电极,用电解KI溶液方法制取,以下有关说法正确的是( )
| A. | 电解时,石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H++2e-═H2↑ | |
| C. | 电解过程中阳极周围溶液的pH变大 | |
| D. | 理论上每生成1molKIO3则电路中流过6mole- |
5.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,方程式表示为:2NH4ClO4$\stackrel{△}{→}$N2↑+Cl2+2O2↑+4H2O 下列对该反应的叙述中错误的是( )
| A. | 瞬间产生大量高温气体推动航天飞机飞行 | |
| B. | 从能量变化的角度,主要是化学能转变为热能和动能 | |
| C. | 反应的焓变大于零 | |
| D. | 在方程式后增加△H及其数值即为热化学方程式 |
12.下列状态的物质,既能导电又属于电解质的( )
| A. | 熔融的KCl | B. | NaCl溶液 | C. | 液态氯化氢 | D. | NaCl晶体 |
9.把10.6g碳酸钠溶于水制成100ml溶液,再从中取出10ml溶液,下列说法正确的是( )
| A. | 碳酸钠的物质的量浓度为0.1mol/L | B. | 碳酸钠的物质的量为0.1mol | ||
| C. | c(Na+)=0.2mol/L | D. | c(Na+)=2mol/L |
10.若7x%和x%的两种液体等体积混合,其质量分数大于4x%,此溶质可能是( )
| A. | H2SO4 | B. | NH3•H2O | C. | NaOH | D. | 乙醇 |
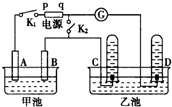 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: