题目内容
3.分别向含有下列离子的溶液中加入NaOH固体(溶液体积不变),能引起离子浓度减少的是( )| A. | Cl- | B. | OH- | C. | [Al(OH)4]- | D. | HCO3- |
分析 溶液中加入NaOH,钠离子、氢氧根离子均增大,且NaOH与HCO3-反应生成碳酸钠和水,以此来解答.
解答 解:A.溶液中加入NaOH,Cl-不变,故A不选;
B.溶液中加入NaOH,钠离子、氢氧根离子均增大,故B不选;
C.溶液中加入NaOH,[Al(OH)4]-离子不变,故C不选;
D.NaOH与HCO3-反应生成碳酸钠和水,则HCO3-减少,故D选;
故选D.
点评 本题考查离子的反应,注意NaOH与HCO3-反应生成碳酸钠和水即可解答,题目较简单.

练习册系列答案
相关题目
13.在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
| A. | 1:0.45 | B. | 1:1 | C. | 1:0.29 | D. | 4.5:2.9 |
11.下列反应的离子方程式中,书写正确的是( )
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
15.食盐中加有KIO3,KIO3在工业上以石墨和铁为电极,用电解KI溶液方法制取,以下有关说法正确的是( )
| A. | 电解时,石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H++2e-═H2↑ | |
| C. | 电解过程中阳极周围溶液的pH变大 | |
| D. | 理论上每生成1molKIO3则电路中流过6mole- |
12.下列状态的物质,既能导电又属于电解质的( )
| A. | 熔融的KCl | B. | NaCl溶液 | C. | 液态氯化氢 | D. | NaCl晶体 |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
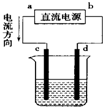

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
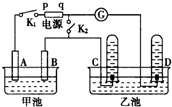 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: