题目内容
19.已知Mg(OH)2的溶度积Ksp=1.8×10-11mol3.L-3,则其饱和溶液中的pH为( )| A. | 3.48 | B. | 3.78 | C. | 10.52 | D. | 10.22 |
分析 Mg(OH)2饱和溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),设c(OH-)=xmol/L,则c(Mg2+)=$\frac{x}{2}$mol/L,结合Ksp=c(Mg2+)×c2(OH-)计算.
解答 解:Mg(OH)2饱和溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),设c(OH-)=xmol/L,则c(Mg2+)=$\frac{x}{2}$mol/L,
则c(Mg2+)×c2(OH-)=$\frac{{x}^{3}}{2}$=1.8×10-11,x=3.3×10-4mol/L,
c(H+)=$\frac{1×1{0}^{-14}}{3.3×1{0}^{-4}}$mol/L,
pH=10.52,
故选C.
点评 本题考查难溶电解质的溶解,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目
6.下列说法中,正确的是( )
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
10.在密闭容器中可逆反应aA(气)+bB(气)?cC(气)+dD(气),△H=Q达化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是( )
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |
7.依据下列相关实验得出的结论不正确的是( )
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 | |
| C. | 用盐酸溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
4.下列说法中,正确的是( )
| A. | 两种难溶盐电解质,其中Ksp小的溶解度一定小 | |
| B. | 溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 | |
| C. | 难溶盐电解质的Ksp与温度有关 | |
| D. | 同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
11.下列反应的离子方程式中,书写正确的是( )
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
9.把10.6g碳酸钠溶于水制成100ml溶液,再从中取出10ml溶液,下列说法正确的是( )
| A. | 碳酸钠的物质的量浓度为0.1mol/L | B. | 碳酸钠的物质的量为0.1mol | ||
| C. | c(Na+)=0.2mol/L | D. | c(Na+)=2mol/L |
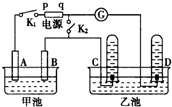 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: