题目内容
1.蛇纹石可用于生产氢氧化镁,简要工程如下:Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
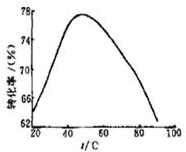
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
分析 (1)步骤Ⅱ中加入适量的H2O2,将溶液中Fe2+氧化成Fe3+,再调节溶液pH至7~8,加入试剂和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,试剂不能引入新的杂质分析;
(2)①步骤Ⅲ中制备氢氧化镁是用氨水沉淀镁离子,注意一水合氨是弱电解质;
50℃前温度与Mg2+转化率之间的关系是:随温度升高镁离子转化率增大,反应是吸热反应;
②温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
解答 解:(1)步骤Ⅱ中加入适量的H2O2,将溶液中Fe2+氧化成Fe3+,再调节溶液pH至7~8,加入试剂和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,试剂不能引入新的杂质,
A.加入氧化镁和酸反应能提高溶液pH,生成镁离子,不加入杂质离子,可选;
B.加入碳酸钠能调节溶液pH,但引入钠离子,故不选;
C.蒸馏水不能使溶液由酸性变为碱性,故不选;
D.加入NaOH能调节溶液pH,但引入钠离子,故不选;
故答案为:将Fe2+氧化成Fe3+;A;
(2)①氨水沉淀镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,
根据图中所示,50℃前温度与Mg2+转化率之间的关系是:随温度升高镁离子转化率增大,反应是吸热反应;
故答案为:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+;吸热;
②图中温度升高至50℃以上Mg2+转化率下降的可能原因是:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降,
故答案为:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
点评 本题考查物质制备方案,涉及物质分离提纯、离子沉淀的条件选择、化学平衡的影响因素、离子方程式的书写、沉淀转化的原理应用,侧重于学生的分析能力和实验能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | N2: | B. | NH3 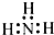 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | HF、H2O、PH3、NH3 |
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
| A. |  AB2 | B. |  EF2 | C. |  XY3Z | D. |  AB3 |
| A. | 1:0.45 | B. | 1:1 | C. | 1:0.29 | D. | 4.5:2.9 |
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O电解_H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
 △H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M.