题目内容
1.如图1是硫酸试剂瓶标签上的内容:(1)该硫酸的摩尔质量是98g/mol,该硫酸的物质的量浓度是18.4mol/L.
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要250mL 4.6mol/L的稀硫酸,则需要取62.5mL的该硫酸.
(3)在配制4.6mol/L的稀硫酸的过程中,下列情况使所配置硫酸溶液物质的量浓度偏低的①(填编号)
①将浓硫酸在烧杯中稀释后注入容量瓶中,没有洗涤烧杯和玻璃棒;
②容量瓶用1mol/L稀硫酸润洗;
③定容时俯视观察液面.
(4)图2表示配制100mL 0.100mol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
①步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是容量瓶.
②将上述实验步骤A→F按实验过程先后次序排列正确的是CBDFAE.
A. A B C D E F
B.C B D F E A
C. C B D F A E
D.D B C F A E

分析 (1)一种物质的摩尔质量在数值上等于该物质的相对分子质量;根据物质的量浓度C=$\frac{1000ρω%}{M}$来计算;
(2)根据稀释定律计算需要浓硫酸的体积;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)①配制一定物质的量浓度溶液的仪器是容量瓶;
②根据配制溶液的实验操作过程进行实验步骤排序.
解答 解:(1)一种物质的摩尔质量在数值上等于该物质的相对分子质量,故硫酸的摩尔质量为98g/mol;硫酸溶液的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,故答案为:98g/mol,18.4mol/L;
(2)由于稀释前后硫酸的物质的量不变,根据稀释定律,需要浓硫酸的体积=$\frac{0.25L×4.6mol/L}{18.4mol/L}$=0.0625L=62.5mL;
(3)①将浓硫酸在烧杯中稀释后注入容量瓶中,没有洗涤烧杯和玻璃棒,会导致溶质的损失,则溶液浓度会偏低,故①正确;
②容量瓶用1mol/L稀硫酸润洗,会导致溶质的量偏多,则浓度偏高,故②错误;
③定容时俯视观察液面,会导致溶液体积偏小,浓度偏高,故③错误.
故选①.
(4)①配制一定物质的量浓度溶液的仪器是容量瓶,所以该仪器的名称是容量瓶,
故答案为:容量瓶;
②操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以实验过程先后次序排列为:CBDFAE,
故答案为:CBDFAE.
点评 本题考查一定物质的量浓度溶液的配制,难度不大,注意实验步骤、误差分析、容量瓶的选取,为易错点.

练习册系列答案
相关题目
11.下列反应的离子方程式中,书写正确的是( )
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
12.下列状态的物质,既能导电又属于电解质的( )
| A. | 熔融的KCl | B. | NaCl溶液 | C. | 液态氯化氢 | D. | NaCl晶体 |
9.把10.6g碳酸钠溶于水制成100ml溶液,再从中取出10ml溶液,下列说法正确的是( )
| A. | 碳酸钠的物质的量浓度为0.1mol/L | B. | 碳酸钠的物质的量为0.1mol | ||
| C. | c(Na+)=0.2mol/L | D. | c(Na+)=2mol/L |
16.能大量共存且溶液是无色的离子组合是( )
| A. | H+、Na+、CO32-、MnO4- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | K+、H+、NO3-、OH- | D. | Mg2+、Ca2+、Cl-、NO3- |
6.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | C(H+)随着温度升高而降低 | B. | 在35℃时,C(H+)>C(OH-) | ||
| C. | 水的电离度(25℃)>(35℃) | D. | 水的电离是吸热的 |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
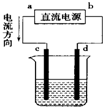

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
10.若7x%和x%的两种液体等体积混合,其质量分数大于4x%,此溶质可能是( )
| A. | H2SO4 | B. | NH3•H2O | C. | NaOH | D. | 乙醇 |
11.下列物质中含原子数最多的是( )
| A. | 6.4g O2 | B. | 8.8g CO2 | C. | 0.1mol N2 | D. | 3.01×1022个H2O |