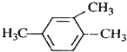
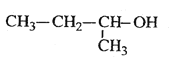ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ Β―ι “÷Τ±ΗΈόΥ°““¥Φ≥Θ”Ο’τΝσΖ®Θ§ Β―ι≤Ϋ÷η»γœ¬ΓΘ
Δώ.ΜΊΝςΓΘ»γΆΦΥυ ΨΘ§‘Ύ100mL‘≤ΒΉ…’ΤΩ÷–Φ”»κ10g–ΓΩ≈ΝΘΉ¥ΒΡ…ζ ·Μ“ΚΆ…ΌΝΩ«β―θΜ·ΡΤΘ§¬ΐ¬ΐΉΔ»κ50mLΙΛ“Β““¥ΦΘ§ΜΊΝς1hΓΘ
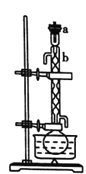
Δρ.’τΝσΓΘ»γΆΦΥυ ΨΘ§ΜΊΝςΆξ±œΘ§¥ΐ…’ΤΩά以Κσ‘Ύ…’ΤΩ÷–Φ”»κΦΗΝΘΖ– ·Θ§ΗΡΈΣ’τΝσΉΑ÷ΟΘ§ ’Φ·78Γφ ±ΒΡΝσΖ÷Θ§Φ¥ΈΣΈόΥ°““¥ΦΓΘ(”ΟΓς±μ ΨΨΤΨΪΒΤ)ΓΘ
‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)ΉΑ÷ΟbΒΡΟϊ≥Τ «________ΓΘ
(2)Φρ ωœρ…’ΤΩ÷–Φ”»κ…ζ ·Μ“ΒΡΖΫΖ®____________ΓΘ
(3)Φ”»κ![]() ΙΧΧε «ΈΣΝΥ≥ΐ»ΞΙΛ“Β““¥Φ÷–…ΌΝΩΒΡ»©Θ§ΖΔ…ζΒΡΖ¥”ΠΈΣ
ΙΧΧε «ΈΣΝΥ≥ΐ»ΞΙΛ“Β““¥Φ÷–…ΌΝΩΒΡ»©Θ§ΖΔ…ζΒΡΖ¥”ΠΈΣ![]() Θ§ΗΟΖ¥”ΠΒΡΖ¥”Πάύ–ΆΈΣ_______Θ§ΜΊΝς1hΒΡΡΩΒΡ «________ΓΘ
Θ§ΗΟΖ¥”ΠΒΡΖ¥”Πάύ–ΆΈΣ_______Θ§ΜΊΝς1hΒΡΡΩΒΡ «________ΓΘ
(4)’τΝσ ±Θ§¥ΐΈ¬Ε»ΦΤ Ψ ΐΈΣ78ΓφΉσ”“ ±Θ§Έ≤Ϋ”Ιή÷–≥ωœ÷“ΚΒΈΘ§Τζ»ΞΩΣ ΦΝς≥ωΒΡ“ΚΧεΘ§‘≠“ρ «_______ΓΘ
(5)”–Ά§―ßΫ®“ιΗΡ’τΝσΈΣΙΐ¬ΥΘ§«κΜΊ¥πΙΐ¬ΥΖ®≤ΜΆΉΒΡ‘≠“ρ «_____ΓΘ
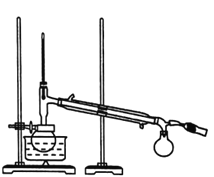
ΓΨ¥πΑΗΓΩ(«ρ–Έ)άδΡΐΙή ΫΪ…’ΤΩΚαΖ≈Θ§”Ο÷Ϋ≤έ(Μρ“©≥Ή)ΫΪΙΧΧεΥΆ»κΒΫ…’ΤΩΒΉ≤ΩΘ§‘Ό¬ΐ¬ΐ÷±ΝΔ…’ΤΩ Φ”≥…Ζ¥”Π Ι![]() ”κ
”κ![]() ΦΑ»©”κ»©≥δΖ÷Ζ¥”Π ΩΣ ΦΝς≥ωΒΡ“ΚΧε÷–Κ§”–ΒΆΖ–ΒψΒΡ‘”÷ Ιΐ¬ΥΈόΖ®≥ΐ»Ξ»ήΫβ‘Ύ““¥Φ÷–ΒΡ”–ΜζΈοΒ»
ΦΑ»©”κ»©≥δΖ÷Ζ¥”Π ΩΣ ΦΝς≥ωΒΡ“ΚΧε÷–Κ§”–ΒΆΖ–ΒψΒΡ‘”÷ Ιΐ¬ΥΈόΖ®≥ΐ»Ξ»ήΫβ‘Ύ““¥Φ÷–ΒΡ”–ΜζΈοΒ»
ΓΨΫβΈωΓΩ
(1)ΗυΨί“«ΤςΒΡΫαΙΙΩ…÷ΣΘ§ΉΑ÷ΟbΒΡΟϊ≥Τ «(«ρ–Έ)άδΡΐΙήΘ§Ι ¥πΑΗΈΣΘΚ(«ρ–Έ)άδΡΐΙήΘΜ
(2)ΗυΨί“©ΤΖΧμΦ”Ιφ‘ρΩ…÷ΣΘ§œρ…’ΤΩ÷–Φ”»κ…ζ ·Μ“ΒΡΖΫΖ® «ΫΪ…’ΤΩΚαΖ≈Θ§”Ο÷Ϋ≤έ(Μρ“©≥Ή)ΫΪΙΧΧεΥΆ»κΒΫ…’ΤΩΒΉ≤ΩΘ§‘Ό¬ΐ¬ΐ÷±ΝΔ…’ΤΩΘ§Ι ¥πΑΗΈΣΘΚΫΪ…’ΤΩΚαΖ≈Θ§”Ο÷Ϋ≤έ(Μρ“©≥Ή)ΫΪΙΧΧεΥΆ»ΥΒΫ…’ΤΩΒΉ≤ΩΘ§‘Ό¬ΐ¬ΐ÷±ΝΔ…’ΤΩΘΜ
(3)Ζ¥”Π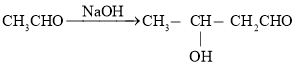 ΈΣ»©ΜυΒΡΦ”≥…Ζ¥”ΠΘΜΜΊΝςΩ…“‘Μ”ΖΔΒΡΈο÷ ΜΊΒΫ…’ΤΩ÷–ΦΧ–χ≤Έ”κΖ¥”ΠΘ§ Ι
ΈΣ»©ΜυΒΡΦ”≥…Ζ¥”ΠΘΜΜΊΝςΩ…“‘Μ”ΖΔΒΡΈο÷ ΜΊΒΫ…’ΤΩ÷–ΦΧ–χ≤Έ”κΖ¥”ΠΘ§ Ι![]() ”κ
”κ![]() ΦΑ»©”κ»©≥δΖ÷Ζ¥”ΠΘ§Ι ¥πΑΗΈΣΘΚΦ”≥…Ζ¥”ΠΘΜ Ι
ΦΑ»©”κ»©≥δΖ÷Ζ¥”ΠΘ§Ι ¥πΑΗΈΣΘΚΦ”≥…Ζ¥”ΠΘΜ Ι![]() ”κ
”κ![]() ΦΑ»©”κ»©≥δΖ÷Ζ¥”ΠΘΜ
ΦΑ»©”κ»©≥δΖ÷Ζ¥”ΠΘΜ
(4)”…”ΎΩΣ ΦΝς≥ωΒΡ“ΚΧε÷–Κ§”–ΒΆΖ–ΒψΒΡ‘”÷ Θ§“ρ¥Υ‘Ύ’τΝσ ±Θ§¥ΐΈ¬Ε»ΦΤ Ψ ΐΈΣ78ΓφΉσ”“ ±Θ§Έ≤Ϋ”Ιή÷–≥ωœ÷“ΚΒΈΘ§“ΣΤζ»ΞΩΣ ΦΝς≥ωΒΡ“ΚΧεΘΜΙ ¥πΑΗΈΣΘΚΩΣ ΦΝς≥ωΒΡ“ΚΧε÷–Κ§”–ΒΆΖ–ΒψΒΡ‘”÷ ΘΜ
(5)Ιΐ¬ΥΈόΖ®≥ΐ»Ξ»ήΫβ‘Ύ““¥Φ÷–ΒΡ”–ΜζΈοΒ»Θ§Ι Ιΐ¬ΥΖ®≤ΜΆΉΘ§Ι ¥πΑΗΈΣΘΚΙΐ¬ΥΈόΖ®≥ΐ»Ξ»ήΫβ‘Ύ““¥Φ÷–ΒΡ”–ΜζΈοΓΘ

ΓΨΧβΡΩΓΩ“―÷Σ25Γφ ±≤ΩΖ÷»θΒγΫβ÷ ΒΡΒγάκΤΫΚβ≥Θ ΐ ΐΨί»γ±μΥυ ΨΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Μ·―ß Ϋ | CH3COOH | H2CO3 | HClO |
ΒγάκΤΫΚβ≥Θ ΐ | Ka=1.8ΓΝ10©¹5 | Ka1=4.3ΓΝ10©¹7 Ka2=5.6ΓΝ10©¹11 | Ka=3.0ΓΝ10©¹8 |
Θ®1Θ©Έο÷ ΒΡΝΩ≈®Ε»ΨυΈΣ0.1molL©¹1ΒΡΥΡ÷÷»ή“ΚΘΚpH”…–ΓΒΫ¥σ≈≈Ν–ΒΡΥ≥–ρ «_______Θ®”Ο±ύΚ≈Χν–¥Θ©
aΘ°CH3COONa bΘ°Na2CO3 cΘ°NaClO dΘ°NaHCO3
Θ®2Θ©≥ΘΈ¬œ¬Θ§0.1molL©¹1 CH3COOH»ή“ΚΦ”Υ°œΓ ΆΙΐ≥Χ÷–Θ§œ¬Ν–±μ¥ο ΫΒΡ ΐΨί±δ¥σΒΡ «_____Θ®ΧνΉ÷ΡΗΘ©_______
A. cΘ®H+Θ© B.![]() C. cΘ®H+Θ©cΘ®OH©¹Θ© D.
C. cΘ®H+Θ©cΘ®OH©¹Θ© D. ![]() E.
E. ![]()
Θ®3Θ©–¥≥ωœρ¥Έ¬»ΥαΡΤ»ή“Κ÷–Ά®»κ…ΌΝΩΕΰ―θΜ·ΧΦΒΡάκΉ”ΖΫ≥Χ ΫΘΚ__________________
Θ®4Θ©25Γφ ±Θ§CH3COOH”κCH3COONaΒΡΜλΚœ»ή“ΚΘ§»τ≤βΒΟΜλΚœ“ΚpH=6Θ§‘ρ»ή“Κ÷–
cΘ®CH3COO©¹Θ©©¹cΘ®Na+Θ©=________Θ®ΧνΉΦ»Ζ ΐ÷ΒΘ©ΓΘ
Θ®5Θ©25Γφ ±Θ§ΫΪa molL©¹1ΒΡ¥ΉΥα”κb molL©¹1«β―θΜ·ΡΤΒ»ΧεΜΐΜλΚœΘ§Ζ¥”ΠΚσ»ή“Κ«ΓΚΟœ‘÷––‘Θ§”ΟaΓΔb±μ Ψ¥ΉΥαΒΡΒγάκΤΫΚβ≥Θ ΐΈΣ____________________________________
Θ®6Θ©±ξΉΦΉ¥Ωωœ¬Θ§ΫΪ1.12L CO2Ά®»κ100mL 1molL©¹1ΒΡNaOH»ή“Κ÷–Θ§”Ο»ή“Κ÷–ΈΔΝΘΒΡ≈®Ε»ΖϊΚ≈Άξ≥…œ¬Ν–Β» ΫΘΚ cΘ®OH©¹Θ©=2cΘ®H2CO3Θ©+_________________________