题目内容
【题目】氮是生命物质的重要组成元素之一,氮的单质及其化合物性质多样,用途广泛。
(1)氮原子核外电子排布式为_________,其最外层电子共有_____种不同的伸展方向。
(2)N2分子是一种极具理论研究价值的分子,它的空间结构如图,是一种正四面体结构(![]() ),则N4是一种_____________分子。(填“极性”或“非极性”)
),则N4是一种_____________分子。(填“极性”或“非极性”)
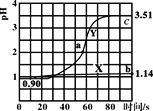
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变为CO2和N2:2NO+2CO ![]() 2CO2 + N2+Q ( Q>0),该反应平衡常数K的表达式为___________;温度升高,K值________(选填“增 大”、“减小”、“不变”);若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_____________________。
2CO2 + N2+Q ( Q>0),该反应平衡常数K的表达式为___________;温度升高,K值________(选填“增 大”、“减小”、“不变”);若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_____________________。
(4)铁盐可用作氮肥,实验室检验铵盐中的 NH4+时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使___________________,说明有NH4+。
【答案】1s22s22p3 4 非极性 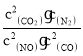 减小 加压 红色石蕊试纸变蓝
减小 加压 红色石蕊试纸变蓝
【解析】
(1)氮的核电荷数为7,原子核外有7个电子,核外电子排布式为1s22s22p3,最外层电子排布式为2s22p3,s轨道为球形,只有一种伸展方向,p轨道为哑铃形,有3种伸展方向,共有4种不同的伸展方向,故答案为:1s22s22p3;4。
(2)N4分子是正四面体结构(![]() ),为非极性分子,故答案为:非极性。
),为非极性分子,故答案为:非极性。
(3)2NO+2CO ![]() 2CO2 + N2+Q ( Q>0),平衡常数是生成物浓度的幂之积比上反应物浓度的幂之积,该反应的平衡常数:K=
2CO2 + N2+Q ( Q>0),平衡常数是生成物浓度的幂之积比上反应物浓度的幂之积,该反应的平衡常数:K=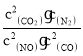 ,该反应的正反应为放热反应,温度升高,平衡逆向移动,K值减小,该反应为气体分子数减小的反应,在密闭容器中,增大压强,平衡正向移动,NO转化率提高,故答案为:K=
,该反应的正反应为放热反应,温度升高,平衡逆向移动,K值减小,该反应为气体分子数减小的反应,在密闭容器中,增大压强,平衡正向移动,NO转化率提高,故答案为:K=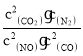 ;减小;加压。
;减小;加压。
(4)铵盐与强碱反应生成氨气,其离子反应方程式为:NH4++OH-=NH3↑+H2O,NH3溶于水显碱性,能使红色石蕊试纸变蓝。所以在实验室检验铵盐中的 NH4+时,取少量铵盐样品于试管中,加入强碱浓溶液,加热,若生成的气体能使红色石蕊试纸变蓝,说明有NH4+,故答案为:红色石蕊试纸变蓝。