题目内容
【题目】按下列要求作答。
(1)第二周期中,第一电离能介于B和N之间的元素共有_________种。
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有_________种。
(3)硅烷(Si,H2H2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___________________________。
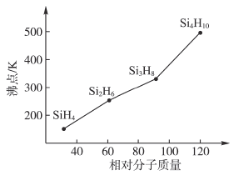
【答案】3 4 硅烷是分子晶体,结构相似,相对分子质量越大,范德华力越大,沸点越高。
【解析】
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有Ti、Ni、Ge、Se,核外电子排布分别为[Ar]3d24s2、[Ar]3d84s2、[Ar]3d104s24p2、[Ar]3d104s24p4;
(3)结构相似的分子晶体,相对分子质量越大,范德华力越大,沸点越高(含有氢键的物质例外)。
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以第二周期中第一电离能顺序为:Li<B<Be<C<O<N,第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)由分析可知,第四周期中,原子核外电子排布有两个未成对电子的元素有Ti、Ni、Ge、Se四种元素;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,范德华力越大,沸点越高。

练习册系列答案
相关题目