题目内容
【题目】氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:____________。
(2)与N3-互为等电子体的分子有:______(写一种)由此可推知N3-的空间构型是:_________; 比较NH2-和NH3的键角∠HNH的大小:NH2- ____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释_______。
(3)叠氮化钠(NaN3)分解可得纯N2,有关说法正确的是:________(选填代号)
A.氮气常温下很稳定,是因为氮元素的电负性大
B.NaN3与KN3结构类似,前者晶格能较小
C.第一电离能(I1):N>P>S
D.热稳定性NH3强于PH3和H2S是因为NH3分子间有氢键
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 ;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如下图所示):
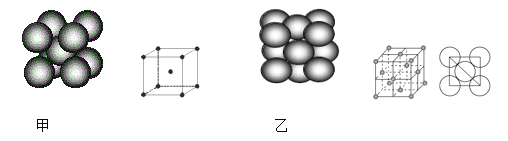
晶胞甲中铁原子的配位数为:_______,晶胞乙中铁原子的堆积方式为:________。晶胞乙中铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为M g/mol。则该晶体的密度可表示为:___________ g/cm3。
【答案】2NaNH2+N2O = NaN3+NaOH+NH3 N2O或CO2或CS2或BeCl2 直线形 < NH2-中N原子孤对电子数为2,NH3中N原子孤对电子数为1,孤对电子数前者多于后者,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,所以键角前者小 C 8 面心立方最密堆积 ![]()
【解析】
(1)根据质量守恒定律来判断反应产物的化学式,再写出反应的方程式;
(2)原子个数相等且价电子相等的微粒为等电子体;根据等电子体的结构相似来分析;根据孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力来分析;
(3)A. N2常温下很稳定,是因为分子内共价键较强;
B. 离子半径越小,晶格能越大;
C. 同周期从左向右,第一电离能增大,但第VA族因p轨道上有3个电子,半充满结构,所以第一电离能高于相邻族的元素,同主族从上到下第一电离能逐渐减小,据此判断;
D. 热稳定性NH3强于PH3和H2S是因为N原子半径小,共价键键能大,与分子间的氢键无关,据此判断;
(4)根据晶胞甲示意图可知原子占据立方体的顶点和体心,可知为体心立方堆积,配位数为8;图乙为面心立方最密堆积,该晶胞中Fe原子个数=8×![]() +6×
+6×![]() =4,每个晶胞的质量=
=4,每个晶胞的质量=![]() ×4,Fe原子的直径为2acm,晶胞的边长为
×4,Fe原子的直径为2acm,晶胞的边长为![]() a,体积为16
a,体积为16![]() a3,由
a3,由![]() =
=![]() 计算晶胞的密度。
计算晶胞的密度。
(1)根据质量守恒定律可知,反应前后原子的种类和数目不变,可确定气体产物为NH3,NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和NH3。方程式为:2NaNH2+N2O = NaN3+NaOH+NH3;
(2)N3-中原子个数为3,价电子数为16,因此与N3-互为等电子体的微粒有:N2O、CO2、CS2、BeCl2、SCN-、OCN-、CNO-等;CO2属于直线形分子,等电子体的结构相同,因此N3-为直线形分子;孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,NH2-中N原子孤对电子数为2,NH3中N原子孤对电子数为1,孤对电子数前者多,所以前者键角小;
(3)A. N2常温下很稳定,是因为分子内共价三键,键能较大,A项错误;
B. 离子半径越小,晶格能越大,NaN3的晶格能大于KN3的晶格能,B项错误;
C. 同周期从左向右,第一电离能增大,但第VA族因p轨道上有3个电子,半充满结构,所以第一电离能高于相邻族的元素,同主族从上到下第一电离能逐渐减小,因此N、P、S的第一电离能的顺序为N>P>S,C项正确;
D. 热稳定性NH3强于PH3和H2S是因为N原子半径小,共价键键能大,与分子间的氢键无关,D项错误;
答案选C;
(4)根据晶胞甲示意图可知原子占据立方体的顶点和体心,可知为体心立方堆积,配位数为8;图乙为面心立方最密堆积;该晶胞中Fe原子个数=8×![]() +6×
+6×![]() =4,每个晶胞的质量=
=4,每个晶胞的质量=![]() ×4,Fe原子的直径为2acm,晶胞的边长为
×4,Fe原子的直径为2acm,晶胞的边长为![]() a,体积为16
a,体积为16![]() a3,因此
a3,因此![]() =
=![]() =
=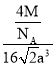 =
=![]() g/cm3。
g/cm3。