题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B.常温常压下, 14 g由N2与CO组成的混合气体含有的原子数目为NA |
| C.0.1L l mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA |
| D.50ml、l8.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
B
解析试题分析:A、不知道NaOH溶液体积,无法求算OH?的数目,错误;B、N2和CO的摩尔质量都是28g/mol,所以14 g由N2与CO组成的混合气体含有的原子数目为:14g÷28g/mol×2 NAmol-1=NA,正确;C、CO32?发生水解反应:CO32?+H2O=HCO3?+OH?,使阴离子数目增多,所以0.1L l mol·L-1Na2CO3溶液中,阴离子总数大于0.1NA,错误;D、随着反应的进行,硫酸的浓度逐渐减小,变为稀硫酸后与铜反应停止,所以生成SO2分子的数目小于0.46NA,错误。
考点:本题考查阿伏伽德罗常数的综合应用。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
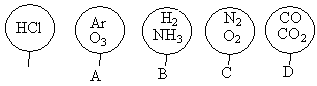
同温同压下,等质量的O2和O3相比较,下列结论正确的是( )
| A.它们的分子数目之比是 1∶1 | B.它们的氧原子数目之比为 2∶3 |
| C.它们的密度之比为 2∶3 | D.它们的体积之比是 1∶1 |
下列说法中,正确的是( )。
| A.22.4 L N2含阿伏加德罗常数个氮分子 |
| B.在标准状况下,22.4 L水的质量约为18 g |
| C.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数 |
| D.标准状况下,相同体积的任何气体单质所含的原子数相同 |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
化学用语是学习化学的重要工具,下列化学用语中,正确的是
| A.硫酸与氢氧化钡中和:H+ + OH- = H2O |
B.碳酸氢钠的水解:HCO3-+ H2O 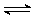 H3O++ CO32- H3O++ CO32- |
C.碳酸钠的水解:CO32-+2H2O  H2O+ CO2+2OH- H2O+ CO2+2OH- |
| D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓+ 3 NH4+ |
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含bmolBaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.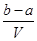 mol·Lˉ1 mol·Lˉ1 | B.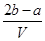 mol·Lˉ1 mol·Lˉ1 |
C. mol·Lˉ1 mol·Lˉ1 | D.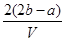 mol·Lˉ1 mol·Lˉ1 |