题目内容
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含bmolBaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.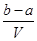 mol·Lˉ1 mol·Lˉ1 | B.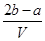 mol·Lˉ1 mol·Lˉ1 |
C. mol·Lˉ1 mol·Lˉ1 | D.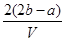 mol·Lˉ1 mol·Lˉ1 |
D
解析试题分析:0.5VL的溶液中,n(SO42-)="b" mol, n(Mg2+)=0.5a mol,根据电荷守恒可得n(K+)=2b-a,所以钾离子的浓度为: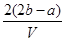 mol·Lˉ1,D正确。
mol·Lˉ1,D正确。
考点:考查了溶液中离子浓度的计算。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B.常温常压下, 14 g由N2与CO组成的混合气体含有的原子数目为NA |
| C.0.1L l mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA |
| D.50ml、l8.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
下列有关化学用语表示正确的是
| A.漂白粉有效成分的化学式:CaClO |
B.Na+的结构示意图: |
C.原子核内有10个中子的氧原子: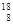 O O |
| D.亚硫酸的电离方程式:H2SO3=2H++SO32- |
1.52 g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.11gT2O含有的中子数为6NA |
| B.1molNa2O2与CO2完全反应转移的电子数为2NA |
| C.常温下,0.2L0.5mol/LNH4NO3溶液的氮原子数小于0.2NA |
| D.标准状况下,2.24LH2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
下列化学用语正确的是
| A.1—丙醇的结构简式:C3H7OH |
| B.羟基(—OH)和氢氧根(OH-) |
C.甲基的电子式: |
| D.乙醛的结构简式:C2H4O |
有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1mol?L﹣1的盐酸的体积为( )
| A.0.05 L | B.0.1 L | C.0.2 L | D.1 L |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1 mol,下列说法一定正确的是
| A.b=2 |
| B.容器中一定没有残余的CO2和水蒸气 |
| C.a:b≥1 |
| D.反应中转移的电子数一定为2NA |