题目内容
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
A
解析试题分析:51.2gCu的物质的量=51.2g÷64g/mol=0.8mol,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,则铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2。其中氮元素的化合价从+5价降低到+3价,所以根据得失电子数目相等得到n(Cu)=n(NaNO2),因此n(NaNO2)=n(Cu)=0.8mol。氢氧化钠的物质的量=0.5L×2mol/L=1.0mol,则根据钠离子守恒可知,硝酸钠的物质的量=1.0mol-0.8mol=0.2mol,答案选A。
考点:考查氧化还原反应的有关计算

 小学能力测试卷系列答案
小学能力测试卷系列答案下列变化一定属于化学变化的是
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩潮解
| A.①②③④⑦ | B.③④⑤⑦ | C.①③④⑦⑩ | D.①③⑤⑦⑨ |
下列叙述正确的是
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑥标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
| A.①②④ | B.①③⑤ | C.②③⑥ | D.②④⑤ |
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则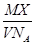 表示的是
表示的是
| A.VL该气体的质量(以g为单位) |
| B.1L该气体的质量(以g为单位) |
| C.1mol该气体的体积(以L为单位) |
| D.1L该气体中所含的分子数 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B.常温常压下, 14 g由N2与CO组成的混合气体含有的原子数目为NA |
| C.0.1L l mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA |
| D.50ml、l8.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
在Na2SO4、NaCl、NaOH的混合溶液中,Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
| A.1:1:1 | B.1:4:2 | C.1:2:4 | D.1:3:2 |
| | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 酸、碱、盐 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 1.5 mol·L-1FeCl3溶液 |
| C.150 mL 3 mol·L-1 KCl溶液 | D.50 mL 3 mol·L-1MgCl2溶液 |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
设NA为阿伏加德罗常数的值。下列说法一定正确的是( )
| A.9.2 g C7H8和C3H8O3的混合物中所含氢原子总数为0.8NA |
| B.标准状况下,11.2 L C2H5OH中所含的分子数为0.5NA |
| C.将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 |
| D.0.1 mol Na2O2参加反应转移的电子数目是0.2NA |