题目内容
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:

请回答下列问题。
(1)滤渣Ⅰ的主要成分是___(填化学式)。
(2)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是___、___、过滤、洗涤、干燥。
(3)还原时,试剂X若选用SO2,则该反应的离子方程式为___。
(4)绿矾(FeSO4·7H2O)若保存不当或长期放置,易与空气中的氧气反应,检验绿矾是否被氧化的方法是___。
【答案】SiO2 蒸发浓缩 冷却结晶 SO2+2Fe3++2H2O=SO42—+2Fe2++4H+ 将绿矾样品溶解于水,取少量于试管中,滴加2~3滴的KSCN溶液,若溶液变血红色,说明绿矾样品已被氧化;若溶液不变色,则未被氧化。
【解析】
烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,滤液中金属阳离子Fe3+、Fe2+、Al3+,在滤液中加入试剂X,还原硫酸铁得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO47H2O。流程图分析如下:
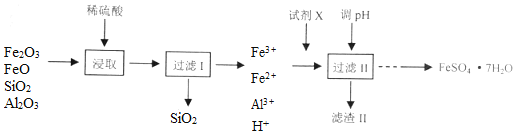
(1)二氧化硅不与稀硫酸反应,滤渣1为二氧化硅;故答案为:SiO2。
(2)滤渣Ⅱ为氢氧化铝,即Al(OH)3,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO47H2O;故答案为:蒸发浓缩;冷却结晶。
(3)试剂X若选用SO2,发生反应:SO2+2Fe3++2H2O=SO42—+2Fe2++4H+。
(4)绿矾样品被氧化会生成Fe3+, Fe3+可使KSCN溶液会变血红色,若变红说明有Fe3+存在即可证明绿矾样品已被氧化,若不变红说明无Fe3+存在,即可证明绿矾样品没变质。具体方法:将绿矾配成溶液,取少量待测液于试管中,向其中滴入2~3滴的KSCN溶液,震荡,观察溶液是否变成红色。

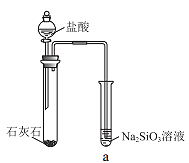
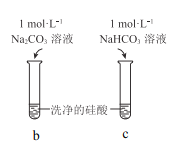
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓