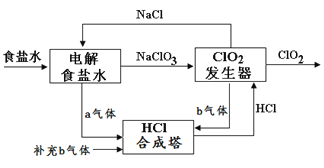
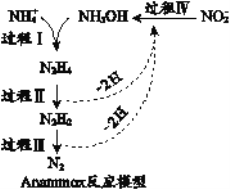
题目内容
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
【答案】D
【解析】
根据阿伏加德罗定律,同温同压下,相同体积的任何气体都含有相同的分子数,据此分析判断。
同温、同压下,气体的Vm相等,则体积相同时,n=![]() 可知,两种气体的物质的量相同,设物质的量都为n,则:①m(N2O)=nM=44n,m(CO2)=nM=44n,故①正确;②N(C)=nNA,N(N)=2n(N2O)×NA=2NA,所含碳原子数与氮原子数不相等,故②错误;③N(N2O)=nNA,N(CO2)=nNA,所含分子数相等,故③正确;故选D。
可知,两种气体的物质的量相同,设物质的量都为n,则:①m(N2O)=nM=44n,m(CO2)=nM=44n,故①正确;②N(C)=nNA,N(N)=2n(N2O)×NA=2NA,所含碳原子数与氮原子数不相等,故②错误;③N(N2O)=nNA,N(CO2)=nNA,所含分子数相等,故③正确;故选D。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
【题目】NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序
物质 | ①NaF | ②NaI | ③MgO |
离子电荷数 | 1 | 1 | 2 |
键长(10-10m) | 2.31 | 3.18 | 2.10 |
A.①>②>③B.③>①>②C.③>②>①D.②>①>③