题目内容
【题目】海水是资源的宝库:合理利用海水资源是当今是世界研究的重点课题。结合所学知识回答下列问题:
(1)列举一项海水中的能源:__________ ,海水中储量最大的资源是________ ,获得该资源最古老的方法是____________。
(2)海水中还有大量NaCl,MgCl2等盐类物质,从海水中获得纯净NaCl的分离提纯方法有过滤、______。
(3)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
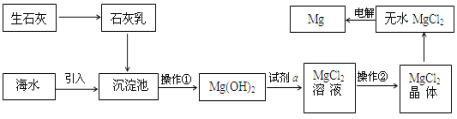
提示: MgCl2晶体的化学式为MgCl26H2O; MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
①操作②的名称___________、冷却结晶、过滤。
②用氯化镁电解生产金属镁的化学方程式为:_____________________。
(4)粗盐提纯后的的卤水中含有大量的溴,从中提取溴的部分过程如下:

实验室模拟上述过程设计以下装置进行实验(所有橡胶制品已被保护,夹持装置已略去)

①A装置中通入a气体的目的是(用离子方程式表示) __________________________________________;
②A装置中先通入a气体后改通热空气。通入热空气的目的是______________________________________;
③B装置中b气体是SO2,目的是吸收富集Br2,此处离子方程式为___________________________________;
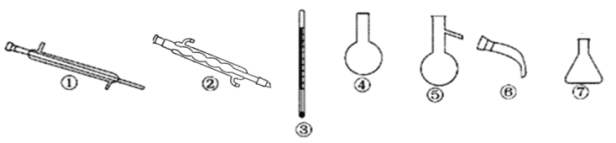
④向B装置中再次通入Cl2得到单质溴,对液体进行蒸馏,收集液溴。蒸馏应该选择下列仪器_____(填序号) 。
 。
。
【答案】潮汐能、核能、氢能源等水蒸馏法结晶蒸发浓缩MgCl2(熔融) ![]() Mg+Cl2↑Cl2+2Br-=2Cl-+Br2吹出Br2Br2+SO2+2H2O=SO42-+2Br-+4H+①③⑤⑥⑦
Mg+Cl2↑Cl2+2Br-=2Cl-+Br2吹出Br2Br2+SO2+2H2O=SO42-+2Br-+4H+①③⑤⑥⑦
【解析】
(1)海水的能源是潮汐能、核能、氢能等;海水中储量最大的资源是水;获得水的最古老的方法是蒸馏法;(2)从海水中提纯NaCl,先加入NaOH、CaCl2、Na2CO3,除去杂质,然后过滤,加入适量的盐酸,最后通过蒸发结晶的方法得到NaCl;(3)①用溶液得到晶体,操作②的名称是蒸发浓缩、冷却结晶、过滤;②氯化镁是离子化合物,电解熔融氯化镁冶炼镁的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑;(4)①a气体为氯气,氯气的氧化性强于Br2,因此装置A的离子反应是Cl2+2Br-=2Cl-+Br2;②液溴是易挥发的液体,通入热空气的目的是吹出Br2;③利用的是Br2的强氧化性,其离子反应方程式为Br2+SO2+2H2O=SO42-+2Br-+4H+;④向B装置中再次通入氯气,氯气将Br-氧化成Br2,蒸馏时需要的用到仪器是①③⑤⑥⑦。
Mg+Cl2↑;(4)①a气体为氯气,氯气的氧化性强于Br2,因此装置A的离子反应是Cl2+2Br-=2Cl-+Br2;②液溴是易挥发的液体,通入热空气的目的是吹出Br2;③利用的是Br2的强氧化性,其离子反应方程式为Br2+SO2+2H2O=SO42-+2Br-+4H+;④向B装置中再次通入氯气,氯气将Br-氧化成Br2,蒸馏时需要的用到仪器是①③⑤⑥⑦。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案





