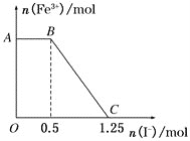
题目内容
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
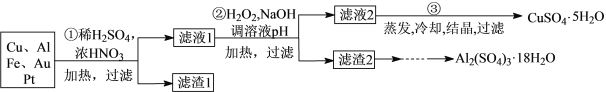
回答下列问题:
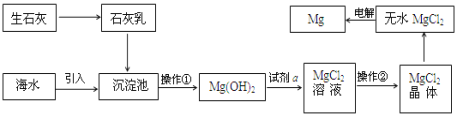
(1)第①步Cu与酸反应的化学方程式为_______________________________________;
得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的的离子方程式为______________________________________;使用H2O2的优点是______________________________________________;调节pH所产生的沉淀的化学式为______、______。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
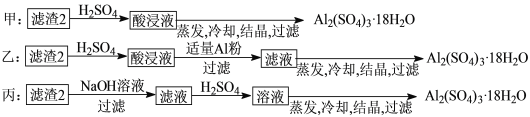
上述三种方案中,可行方案是______,其中不可行方案的原因是______________________。
【答案】Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑ Au和pt H2O2+2Fe2++2H+=2Fe3++2H2O 绿色环保,无污染物产生 Al(OH)3 Fe(OH)3 加热蒸干或加浓硫酸吸水 乙和丙 甲中无法除去Fe3+
【解析】
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Fe2+、Al3+、Cu2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Fe2+、Al3+、Cu2+;铜与浓硝酸反应生成二氧化氮和硝酸铜,据此写出反应方程式;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;过氧化氢把亚铁离子氧化为铁离子易于沉淀除去,调节溶液pH目的是铁离子和铝离子全部沉淀;
(3) 第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水或加浓硫酸吸水;
(4) 根据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率等因素分析判断。
(1) 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Fe2+、Al3+、Cu2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Fe2+、Al3+、Cu2+;Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑;综上所述,本题答案是:Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑; Au和pt 。
(2) 第②步加H2O2的作用是将Fe2+氧化为Fe3+,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O ;过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染,绿色环保;调节溶液pH使铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜;综上所述,本题答案是:H2O2+2Fe2++2H+=2Fe3++2H2O ;绿色环保,无污染物产生;Al(OH)3 ;Fe(OH)3。
(3) 第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水或加浓硫酸吸水 ; 因此,本题正确答案是:加热脱水或加浓硫酸吸水。
(4)甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3反应生成Al2(SO4)3,对滤液进行蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行,乙和丙可行;因此,本题正确答案是: 乙和丙;甲中无法除去Fe3+。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案