题目内容
【题目】如图所示,将浸透了石蜡油的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,关于该实验的分析正确的是( )
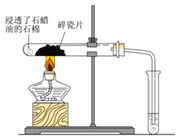
A.石棉的作用是催化剂
B.碎瓷片的作用是防暴沸
C.若小试管中的液体是酸性高锰酸钾,则其褪色的原因是石蜡油挥发
D.若小试管中的液体是溴水,一段时间后会观察到其褪色并分层
【答案】D
【解析】
A.石蜡油附着于石棉上,受热时附着的石蜡油转化为气态,所以石棉是载体,没有起到催化作用,故A错误;
B.石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的乙烯气体,所以碎瓷片的作用是催化剂,故B错误;
C.石蜡油蒸汽在碎瓷片催化作用下生成乙烯,酸性高锰酸钾能氧化乙烯而褪色,故C错误;
D.乙烯能与溴水中的溴发生加成反应,生成1,2-二溴乙烷,1,2-二溴乙烷是不溶于水、密度比水大的油状液体,所以溴水褪色并分层,故D正确;
故选:D。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】CuAlO2是重要化工品,(NH4)2Fe(SO4)2·6H2O(摩尔盐)是化学上常用的分析试剂。某小组以黄铜矿(主要成分是CuFeS2,含少量SiO2)为原料制备这两种化工品,流程如图:

已知:①几种氢氧化物的开始沉淀和完全沉淀的pH,如表所示。
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀/pH | 4.7 | 7.6 | 2.7 |
完全沉淀/pH | 6.7 | 9.6 | 3.7 |
②4CuO+4Al(OH)3![]() 4CuAlO2+6H2O+O2↑
4CuAlO2+6H2O+O2↑
回答下列问题:
(1)CuAlO2中铜的化合价为__;滤渣1的主要成分是__(填化学式)。
(2)反应物中铁元素被氧化的目的是__。
(3)提高这两种方案中“酸浸”反应速率都需要加热,但温度都不宜过高,其原因是__。
(4)在混酸法中,CuFeS2溶于混酸生成Cu2+,Fe3+,SO42-和一种无色气体,该气体遇空气迅速变为红棕色。写出CuFeS2与混酸反应的离子方程式__。
(5)评价上述流程,补充完整:
优点 | 缺点 | |
细菌法 | ①__ | 化学反应慢,需要时间长 |
混酸法 | 节省时间 | ②___ |
【题目】氧化亚铜(Cu2O)可用于陶瓷、固体整流器,可用下列反应制备:2(CuSO4H2O)![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为________________。上述反应中,电负性最大的元素是________________(填元素符号)
(2)元素Cu和Ni相邻,其第一、二电离能数据如表所示:
I1/(kJ/mol) | I2/(kJ/mol) | |
Ni | 737.1 | 1753.0 |
Cu | 745.5 | 1957.9 |
铜的第一、二电离能都比镍对应的高,其原因除了铜的核电荷数比多,对外电子的吸外力大外,还有一个原因是________。
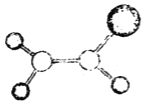
(3)已知H2SO4的结构式如图所示,上述反应中:

①在上述产物中,VSEPR模型与SO42-相同的是________(填化学式)
②SO3分子的立体构型是________________,写出一种与SO3互为等电子体的离子:________(填离子符号)
(4)Cu2+、Cu+与CN-、OH-、NH3、H2O等组成多种配离子。[Cu(NH3)4]2+中的Cu2+配位数为________。
(5)铜元素和氧元组成一种晶体M,M的晶胞如图所示。

已知:NA是阿伏加德罗常数的值,M晶体密度为dgcm-3。M的晶胞中Cu+、Cl-个数比为________,晶胞参数为________pm(用含d和NA的代数式表示)。(用含d和NA的代数式表示)