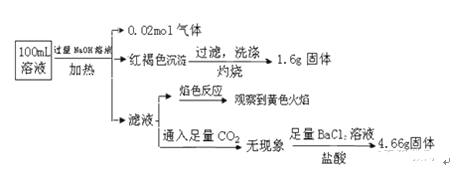
题目内容
【题目】 醋酸由于成本较低,在生产中被广泛应用。
(1)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛作中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:CH2=CH2(g)+CH3COOH(l)![]() CH3COOC2H5(l)下列描述能说明恒温恒容条件下乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是________(填字母)。
CH3COOC2H5(l)下列描述能说明恒温恒容条件下乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是________(填字母)。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗 1 mol
D.整个体系中乙烯的质量分数一定
E.气体的总压强不变
F.气体的摩尔质量不变
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:
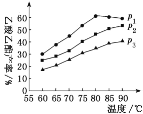
①根据上图判断压强大到小的顺序是________,分析其原因_____。
②压强为p1、温度为60℃时,若乙酸的转化率为40%,则此时乙烯的转化率为____。
③在压强为p1、温度超过80℃时,分析乙酸乙酯产率下降的原因:_____
④根据测定实验结果分析,较适宜的生产条件是________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________(任写出一条)。
【答案】BD p1>p2>p3 其它条件相同时,对于有气体参加的反应,化学反应速率越快压强越大 40% 由图象可知,压强为p1,温度为80℃时,反应已到达平衡,且正反应是放热反应,故压强不变,升高温度平衡逆向移动,产率下降 p1、80℃ 通入乙烯气体(或增大压强)
【解析】
(1)根据化学平衡状态的特征分析,当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;
(2)①压强越大,反应速率越大;
②压强为p1MPa、温度60℃时,若乙酸乙酯的产率为30%,依据化学平衡物质转化关系,计算得到乙烯反应量,转化率=![]() ×100%;
×100%;
③在压强为p1MPa、温度超过80℃时,乙酸乙酯产率下降,说明升温平衡逆向进行;
④选择适宜条件使得乙酸乙酯产率达到最大,为提高乙酸乙酯的合成速率和产率,赢是改变的条件加快反应速率且平衡正向进行。
(1)A.乙烯、乙酸、乙酸乙酯的浓度相同时,反应可能处于平衡状态,也可能未达到平衡状态,因此不能说明正逆反应速率相同,A错误;
B.酯化合成反应的速率与酯分解反应的速率相等,说明正、逆反应速率相同,B正确;
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,只能说明反应正向进行,不能判断反应处于平衡状态,C错误;
D.体系中乙烯的百分含量一定,说明反应处于平衡状态,D正确;
E.反应混合物中只有乙烯是气体,因此任何条件下气体的总压强都不变,不能据此判断反应处于平衡状态,E错误;
F.只有乙烯是气体,气体的摩尔质量始终不变,不能据此判断反应处于平衡状态,F错误;
故合理选项是BD;
(2)①CH2=CH2(g)+CH3COOH(l)![]() CH3COOC2H5(l),温度一定,压强增大平衡正向进行,反应速率增大,图象分析可知p1>p2>p3,则温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是v(p1)>v(p2)>v(p3);
CH3COOC2H5(l),温度一定,压强增大平衡正向进行,反应速率增大,图象分析可知p1>p2>p3,则温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是v(p1)>v(p2)>v(p3);
②反应方程式:CH2=CH2(g)+CH3COOH(l)![]() CH3COOC2H5(l),反应开始时,n(C2H4)=n(CH3COOH)=1mol,n(CH3COOC2H5)=0mol,假设反应过程中乙烯变化的物质的量是x,则根据物质反应的转化关系可知,平衡时各种物质的物质的量n(C2H4)=n(CH3COOH)=(1-x)mol,n(CH3COOC2H5)=xmol。由于乙酸乙酯的产率为30%,则生成乙酸乙酯0.3mol,反应消耗乙烯0.3mol,所以乙烯的转化率=(0.3mol÷1mol)×100%=30%;
CH3COOC2H5(l),反应开始时,n(C2H4)=n(CH3COOH)=1mol,n(CH3COOC2H5)=0mol,假设反应过程中乙烯变化的物质的量是x,则根据物质反应的转化关系可知,平衡时各种物质的物质的量n(C2H4)=n(CH3COOH)=(1-x)mol,n(CH3COOC2H5)=xmol。由于乙酸乙酯的产率为30%,则生成乙酸乙酯0.3mol,反应消耗乙烯0.3mol,所以乙烯的转化率=(0.3mol÷1mol)×100%=30%;
③在压强为p1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是:由图象可知,p1MPa、80℃时反应已达平衡且该反应的正反应是放热反应,所以在压强不变时升高温度,化学平衡向吸热的逆向移动,导致乙酸乙酯的产率下降;
④选择适宜条件使得乙酸乙酯产率达到最大,根据图象中乙酸乙酯产率最大的条件是:p1MPa、80℃;为提高乙酸乙酯的合成速率和产率,应是改变的条件加快反应速率且平衡正向进行,可以增大反应物浓度或增大压强等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案