题目内容
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是 ( )
①46g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥1 mol Na2O2与水完全反应时转移电子数为2NA
A.①②④B.①②⑤C.③⑤⑥D.④⑤⑥
【答案】B
【解析】
由题可知①NO2和N2O4的最简式相同,只需要计算46g NO2中原子数=![]() ×3NA=3NA,故①正确。
×3NA=3NA,故①正确。
②4g CH4物质的量为0.25mol,分子中含C-H共价键4×0.25×NA=NA,故②正确。
③加水至100mL溶液的密度变了,无法求出,故③错误。
④四氯化碳是液态不是气态,标准状况下,5.6L四氯化碳的物质的量不是0.25mol,故④错误。
⑤25℃时,pH=12的1.0L NaClO溶液中氢氧根离子的物质的量为0.01mol,溶液中氢氧根离子是水电离的,所以水电离出的OH-的数目为0.01NA,故⑤正确。
⑥2Na2O2+2H2O=4NaOH+O2↑,每生成1molO2时,2molNa2O2与水完反应中转移的电子为2NA,故⑥错误。
故正确的是①②⑤,故答案选B。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
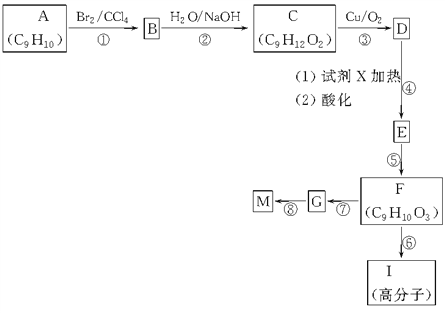
学业测评一课一测系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
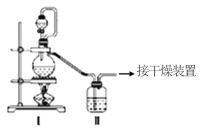
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
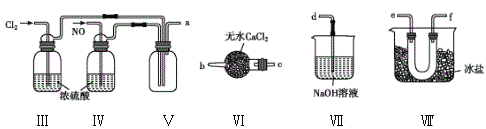
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。