题目内容
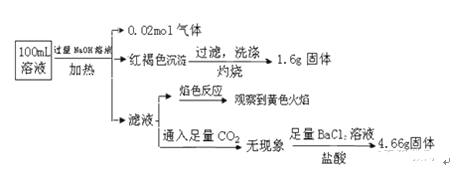
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
【答案】A
【解析】
试题向溶液中加入过量的NaOH溶液,加热产生0.02mol的气体,证明含有NH4+,n(NH4+)=0.02mol;产生红褐色沉淀Fe(OH)3,证明在溶液中含有Fe3+,但是不能确定是否含有Fe2+。将沉淀过滤灼烧,产生Fe2O3,n(Fe2O3) =1.6g÷160g/mol=0.01mol;根据Fe元素守恒可得:n(Fe3+)=2n(Fe(OH)3)=0.02mol;c(Fe3+)=0.02mol÷0.1L=0.2mol/L;所以选项A正确;由于加入NaOH溶液,所以在反应后的溶液中一定含有Na+,因此焰色反应呈黄色,则不能证明在原溶液中是否含有Na+;选项C错误;向滤液中通入CO2无现象,证明无Al3+;再加入足量的BaCl2溶液和盐酸,产生白色沉淀BaSO4的质量是4.66g,证明含有SO42ˉ。n(SO42ˉ)=4.66g÷233g/mol=0.02mol。溶液呈电中性,阴离子带有的负电荷总数是2n(SO42ˉ)=0.04mol;阳离子带有的正电荷总数是:3n(Fe3+)+ n(NH4+)="3×0.02mol+" 0.02mol=" 0.08mol" >0.04mol,说明还含有阴离子。由于Fe3+与CO32ˉ不能大量共存,所以一定含有Cl-;n(Cl-)=" 0.08mol" -0.04mol=0.04mol;c(Cl-)=0.04mol÷0.1L=0.4mol/L,选项B错误。

【题目】下列有关实验操作、现象、目的及结论都正确的是
选项 | 实验 | 现象结论 |
A | 向浓度均为 0.1 molL1 NaCl 和 Na2CrO4混合溶液中滴加0.1 molL1 AgNO3 溶液,先生成白色的AgCl沉淀 | 能证明Ksp(AgCl)< Ksp(Ag2CrO4) |
B | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 | 不能区别植物油和矿物油 |
C | 其他条件相同,一只试管中加入5mL 0.2mol/LH2C2O4 (aq)和2.5L 0.1mol/L KMnO4(aq);另一支试管中加入7.5ml 0.2moI/L H2C2O4 (aq)和 2.5mL 0.2mol/L KMnO4(aq) 和5mlH2O | 可验证相同条件下浓度对化学反应速率的影响 |
D | 常温下,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH | 能证明酸性:HA>H2CO3 |
A. A B. B C. C D. D
【题目】氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾
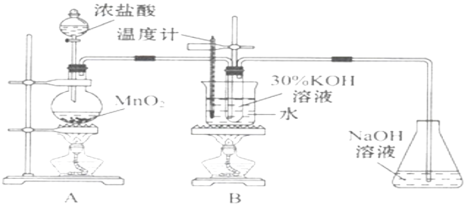
(1)A中反应的化学方程式为_______。实验开始时,首先进行的实验步骤是________。
(2)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是__(填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(3)该小组研究条件对反应产物的影响,系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__.②设计1号试管实验的作用是__.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为______ .