题目内容
19.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一.SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):①KMnO4+KF+H2O2+HF→K2MnF6+O2+H2O ②SbCl5+HF→SbF5+HCl
③K2MnF6+SbF5→KSbF6+MnF3+F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为1:3;反应③中SbF5表现的性质为酸性.
分析 KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中双氧水中O元素化合价由-1价变为0价、Mn元素化合价由+7价变为+4价,根据转移电子相等配平方程式,得出氧化剂和被氧化的元素的物质的量之比;③K2MnF6+SbF5→KSbF6+MnF3+F2↑,K2MnF6中Mn元素的化合价降低,F元素的化合价升高,据此回答.
解答 解:反应①KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中,双氧水中O元素化合价由-1价变为0价、O元素被氧化,Mn元素化合价由+7价变为+4价,根据转移电子相等得转移电子数为6,再结合原子守恒配平方程式为:2KMnO4+3H2O2+2KF+10HF=2K2MnF6+3O2↑+8H2O,KMnO4是氧化剂,O元素被氧化,
氧化剂和被氧化的元素的物质的量之比为2:6=1:3,③K2MnF6+SbF5→KSbF6+MnF3+F2↑中,K2MnF6中Mn元素的化合价降低,其中F元素的化合价升高,SbF5中元素的化合价都没变,所以③中SbF5表现的性质为酸性,故答案为:1:3;酸.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的计算及电子守恒的应用,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
9.下列说法中错误的是( )
| A. | 氢是原子半径最小的元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 周期表中有7个主族、7个副族 | |
| D. | 硫元素位于第三周期VIA族 |
10.下列说法正确的是( )
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增加 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
14.下列根据实验操作和现象所得出的结论正确的是下列根据实验操作和现象所得出的结论正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
4.某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一种电极的材料与电解质溶液的说明中肯定错误的是( )
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
11.下列电子式正确的是( )
| A. | H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| C. | ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 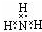 |
8.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)除稀有气体外,元素中原子半径最大的是K,其离子的结构示意图为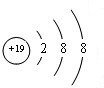
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为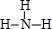 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为
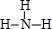 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
9.现有六种元素,其中A、B、C、D为短周期主族元素,EF为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
(2)E的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
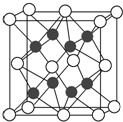 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.