题目内容
4.某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一种电极的材料与电解质溶液的说明中肯定错误的是( )| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
分析 某含有铝电极的原电池工作时,电子从铝电极上流出吗,则金属铝是负极,正极材料的活泼性比金属铝弱,电解质和金属铝之间可以发生自发氧化还原反应即可.
解答 解:含有铝电极的原电池工作时,电子从铝电极上流出吗,则金属铝是负极,正极材料的活泼性比金属铝弱,电解质和金属铝之间可以发生自发氧化还原反应.
A、镁、Al、NaOH溶液能够成原电池,金属铝是负极,故A不选;
B、铜、铝、稀硫酸溶液能够成原电池,金属铝是负极,故B不选;
C、锌、Al、浓硝酸溶液能够成原电池,金属铝是正极,故C选;
D、铁、FeCl3、Al能够成原电池,金属铝是负极,故D不选;
故选C.
点评 本题考查学生原电池的构成条件以及负极的判断,不是活泼金属一定做负极,电子流出的极是负极,难度中等.

练习册系列答案
相关题目
16.生活处处有化学,下列说法正确的是( )
| A. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| B. | 淀粉及做衣服的棉和麻均为天然高分子化合物 | |
| C. | 煎炸食物的花生油和牛油都是可水解的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
13.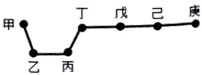 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |

 ,E的化学式为NO.
,E的化学式为NO.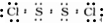 .
. .
.