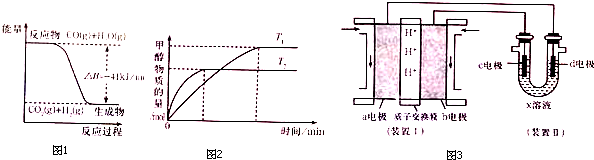
题目内容
7.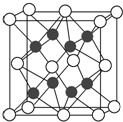 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.(1)其中O2-离子的配位数为8,
(2)该化合物与MgO相比,熔点较高的是MgO.(填化学式)
(3)已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
分析 (1)在晶胞结构图中,空心球数目为$8×\frac{1}{8}+6×\frac{1}{2}$=4,实心球数目为8,结合化合物Na2O可知图中实心球表示化合物Na+,空心球表示O2-,以顶点空心球为例,周围距离最近的实心球有8个,据此答题;
(2)Na2O与MgO都是离子晶体,根据离子半径与晶格能的关系可判断熔点高低;
(3)根据$ρ=\frac{m}{V}$计算晶体的密度.
解答 解:(1)在晶胞结构图中,空心球数目为$8×\frac{1}{8}+6×\frac{1}{2}$=4,实心球数目为8,结合化合物Na2O可知图中实心球表示化合物Na+,空心球表示O2-,以顶点空心球为例,周围距离最近的实心球有8个,所以O2-离子的配位数为8,
故答案为:8;
(2)Na2O与MgO都是离子晶体,钠离子半径大于镁离子,所以氧化镁的晶格能大于氧化钠,所以MgO根据的熔点高于Na2O,
故答案为:MgO;
(3)根据(1)中的计算可知,每个晶胞中含有4个氧离子和8个钠离子,所以晶体的密度$ρ=\frac{m}{V}$=$\frac{\frac{4×(46+16)}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g•cm-3=$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3,
故答案为:$\frac{248}{a{N}_{A}×1{0}^{-30}}$.
点评 本题考查晶胞的结构、晶体的性质和晶胞密度计算,难度不大,答题时注意利用均摊法计算出晶胞中所含微粒数.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
17.下列指定微粒的个数比等于2:1的是( )
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
18.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
16.生活处处有化学,下列说法正确的是( )
| A. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| B. | 淀粉及做衣服的棉和麻均为天然高分子化合物 | |
| C. | 煎炸食物的花生油和牛油都是可水解的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
17.下列说法中不正确的是( )
| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
 .
. .
.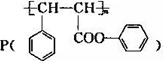 是一种环保型的新涂料,其合成路线如下图所示:
是一种环保型的新涂料,其合成路线如下图所示: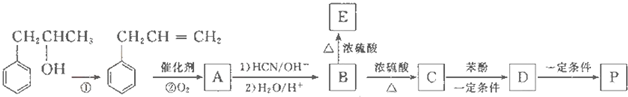
 .
. .
. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).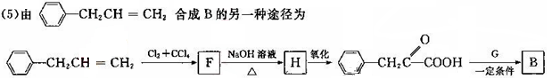
 ,试剂G的化学式H2.
,试剂G的化学式H2.