题目内容
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
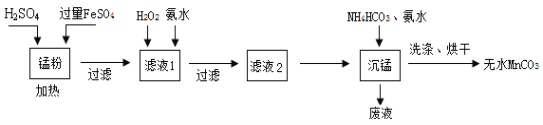
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。
【答案】把二氧化锰完全转化成二价锰离子 2Fe2++H202+2H+= 2Fe3++2H2O 38 促进HCO3-离子的电离,提供出CO32-来沉锰 取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净 硫酸铵和氨水
【解析】
(1)根据提供的方程式可以看出FeSO4作用为把二氧化锰完全转化成二价锰离子;
(2)氧化还原反应方程式书写注意考虑溶液的酸碱性;pH计算要两步,不能让Mn2+
沉淀而且要让三价铁完全沉淀;
(3)碱性来促进HCO3-离子的电离,提供出CO32-来沉锰,溶液中主要有硫酸根离子,可根据其离子的沉淀法来考虑是否涤干净;
(4)根据守恒不难发现其成分主要为硫酸铵和过量氨水。
(1)根据提供的方程式可以看出FeSO4作用为把二氧化锰完全转化成二价锰离子,故答案为:把二氧化锰完全转化成二价锰离子;
(2)往滤液1中先加入H2O2将Fe2+氧化成Fe3+,该反应的离子方程式为: 2Fe2++H202+2H+= 2Fe3++2H2O;后加入氨水调节pH使Fe3+转化为Fe(OH)3沉淀而除去,根据Ksp[Fe(OH)3]=10-38,Fe3+完全沉淀时得:c(OH-)=![]() =10-11mol/L,c(H+)=1×10-3mol/L,Fe3+沉淀完全时溶液的pH=3;不能让Mn2+沉淀,则根据Mn(OH)2的溶度积常数得:Ksp[Mn(OH)2]=c(Mn2+) c2(OH-)=0.1 mol·L-1×c2(OH-)=10-13,c(OH-)=
=10-11mol/L,c(H+)=1×10-3mol/L,Fe3+沉淀完全时溶液的pH=3;不能让Mn2+沉淀,则根据Mn(OH)2的溶度积常数得:Ksp[Mn(OH)2]=c(Mn2+) c2(OH-)=0.1 mol·L-1×c2(OH-)=10-13,c(OH-)=![]() =10-6mol/L,c(H+)=1×10-8mol/L,Mn2+开始沉淀时溶液的pH=8,所以需调节溶液的pH范围为38,
=10-6mol/L,c(H+)=1×10-8mol/L,Mn2+开始沉淀时溶液的pH=8,所以需调节溶液的pH范围为38,
故答案为:2Fe2++H202+2H+= 2Fe3++2H2O;38;
(3)根据流程图,沉锰工序中,加入碳酸氢铵和氨水生成碳酸锰,所以加氨水的目促进HCO3- 离子的电离,提供出CO32-来沉锰;溶液中含有硫酸根,所以可以根据是否存在硫酸根离子来判断沉淀是否洗涤干净,实验操作为:取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净;
故答案为:促进HCO3-离子的电离,提供出CO32-来沉锰;取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净;
(4)根据流程图知,刚开始加入了硫酸溶液和FeSO4,后来加入过量氨水,结合各阶段的反应,所以废液中的主要成份为硫酸铵和氨水,
故答案为:硫酸铵和氨水。

【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)