题目内容
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
【答案】C
【解析】
混合气体通过浓H2SO4,体积减少30mL,即V(NH3)=30mL,由NH3的存在知不可能有HCl气体,则剩余气体为CO2和NO体积为100mL-30mL=70mL。若剩余气体只有NO,则通过Na2O2固体气体体积不变,若完全为二氧化碳,根据反应2CO2+2Na2O2=2Na2CO3+O2可知,70mL二氧化碳完全反应生成35mL气体,气体体积减少了35mL,所以剩余的70mL为NO和CO2。设CO2体积为x, NO为y,由反应方程式:可知生成的O2体积为![]() ;根据反应
;根据反应
![]()
![]()
再经过Na2O2固体后,气体体积又减少了15mL,则:0.5x+0.5y=15mL即x+y=30mL<70mL,说明二氧化碳不足,NO过量,反应后得到的气体为NO2、NO,其总气体体积为:70mL-15mL=55mL,最后经过水洗后,剩余的45mL为NO,发生反应为:3NO2+H2O=2HNO3+NO,设55mL混合气体中NO、NO2的体积分别为x、y,则:x+y=55mL、x+![]() y=45mL,解得:x=40mL、y=15mL;根据反应2NO+O2=2NO2可知,二氧化碳与过氧化钠反应生成氧气的体积为7.5mL,根据2CO2+2Na2O2=2Na2CO3+O2可知原混合气体中CO2的体积为15mL;所以原混合气体中NO的体积为:70mL-15mL=55mL,所以V(NH3):V(HCl):V(CO2):V(NO)=30:0:15:55= 6∶0∶3∶11,故C正确;
y=45mL,解得:x=40mL、y=15mL;根据反应2NO+O2=2NO2可知,二氧化碳与过氧化钠反应生成氧气的体积为7.5mL,根据2CO2+2Na2O2=2Na2CO3+O2可知原混合气体中CO2的体积为15mL;所以原混合气体中NO的体积为:70mL-15mL=55mL,所以V(NH3):V(HCl):V(CO2):V(NO)=30:0:15:55= 6∶0∶3∶11,故C正确;
答案:C。

 53随堂测系列答案
53随堂测系列答案【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
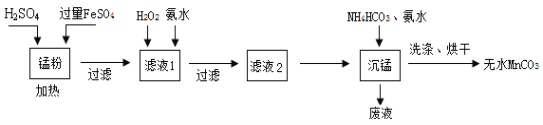
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。