题目内容
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
【答案】C
【解析】
A.由表格数据可知,0.1mol/L的弱酸盐溶液中水解程度由大到小的顺序为Na2CO3>NaClO>NaHCO3>NaF,根据盐类水解规律“越弱越水解”,可推知对应酸的酸性由强到弱的顺序为:HF>H2CO3>HClO>HCO3-,A项正确;
B.由表格数据知0.1mol/LNaF溶液中pH=7.5,常温下该溶液中c(OH-)=![]() =
=![]() =10-6.5mol/L,c(HF)= 10-6.5mol/L-10-7.5mol/L=9×10-7.5mol/L,根据F-+H2O
=10-6.5mol/L,c(HF)= 10-6.5mol/L-10-7.5mol/L=9×10-7.5mol/L,根据F-+H2O![]() HF+OH-得水解平衡常数Kh=
HF+OH-得水解平衡常数Kh=![]() =
=![]() ≈9×10-13,B项正确;
≈9×10-13,B项正确;
C. 因Na2CO3溶液和NaHCO3溶液均呈碱性,只有H2CO3溶液呈酸性,所以将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性时,发生的反应有Na2CO3+CO2+H2O=2NaHCO3,CO2+H2O=H2CO3,所得溶液为NaHCO3(浓度为0.2mol/L)和H2CO3的混合溶液,根据物料守恒,溶液中有c(CO32-)+c(HCO3-)+ c(H2CO3)>0.2mol/L,C项错误;
D.由B项分析知,相同温度下HF的电离常数Ka=![]() ≈
≈![]() =0.011,故有Ka>Kh,说明HF的电离程度大于NaF的水解程度,所以等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> c (H+)>c(OH-),D项正确;答案选C。
=0.011,故有Ka>Kh,说明HF的电离程度大于NaF的水解程度,所以等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> c (H+)>c(OH-),D项正确;答案选C。

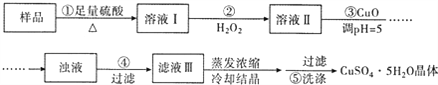
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
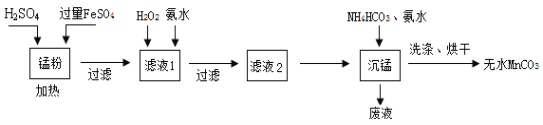
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。