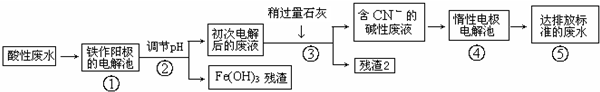
题目内容
16.下列各组离子在指定溶液中一定能大量共存的是( )①澄清透明溶液中:K+、Na+、MnO4-、SO42-
②石蕊呈蓝色的溶液中:Na+、Al3+、NO3-、HCO3-
③在pH=1的溶液中:Fe3+、NO3-、F -、Na+
④含大量OH-的溶液中:CO32-、Cl-、F-、K+
⑤在pH=0的溶液中:Na+、NO3-、SO32-、K+
⑥常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Na+、Al3+、NO3-、Cl-.
| A. | ①③④⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ④⑤⑥ |
分析 ①四种离子之间不发生反应,能够大量共存;
②石蕊呈蓝色的溶液中存在大量氢氧根离子,氢氧根离子与铝离子、碳酸氢根离子反应,铝离子与碳酸氢根离子发生双水解反应;
③在pH=1的溶液中存在大量氢离子,氟离子与氢离子反应生成氟化氢;
④四种离子之间不发生反应,都不与氢氧根离子反应;
⑤在pH=0的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚硫酸根离子;
⑥常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中存在大量氢离子,Na+、Al3+、NO3-、Cl-之间不反应,都不与氢离子反应.
解答 解:①K+、Na+、MnO4-、SO42-离子之间不发生反应,且为澄清透明溶液,在溶液中能够大量共存,故①正确;
②石蕊呈蓝色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+、HCO3-离子之间发生双水解反应,Al3+、HCO3-且都与氢氧根离子反应,在溶液中不能大量共存,故②错误;
③在pH=1的溶液为酸性溶液,溶液中存在大量氢离子,F-离子与氢离子反应生成HF,在溶液中不能大量共存,故③错误;
④CO32-、Cl-、F-、K+离子之间不反应,都不与OH-反应,在溶液中能够大量共存,故④正确;
⑤在pH=0的溶液为酸性溶液,溶液中存在大量氢离子,NO3-、SO32-离子在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故⑤错误;
⑥常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液为酸性溶液,溶液中存在大量氢离子,Na+、Al3+、NO3-、Cl-离子之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故⑥正确;
根据分析可知,能够大量共存的为:①④⑥,
故选C.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

(部分短周期元素的原子半径及主要化合价)
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | M与T形成的化合物熔沸点高 | |
| B. | 最高价氧化物对应的水化物碱性:L<Q | |
| C. | 氢化物的还原性:H2 R<H2 T | |
| D. | 离子半径:T2-<L2+ |









 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.