题目内容
15.现有反应:A.CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑B.Zn+H2SO4═ZnSO4+H2↑
C.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO
D.2KOH+H2SO4═K2SO4+2H2O
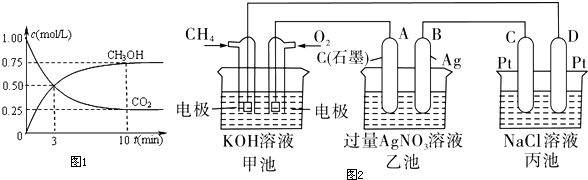
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图1的是C(填反应序号).
(2)在常温下,上述四个反应中可用于设计原电池的是B(填反应序号),根据该原电池回答下列问题:
①负极材料是锌,负极发生氧化(填“氧化”或“还原”)反应;正极反应式为2H++2e-=H2↑.
②当导线中有1mol电子通过时,理论上发生的变化是bc填序号).
a.溶液增重32.5g b.溶液增重31.5g c.析出1g H2 d.析出11.2LH2
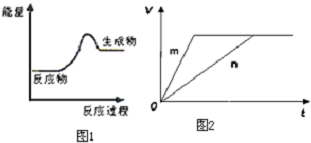
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuS04溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图2所示.
①m曲线表示锌与稀硫酸X(填“X”或“Y”)反应.
②锌分别与稀硫酸X、Y反应时,反应速率不同
的原因是c(填序号).
a.CuS04作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积.
分析 (1)图1为生成物能量大于反应物能量,则该反应为吸热反应,根据是否有化合价变化判断是否为氧化还原反应;
(2)能设计成原电池的反应通常是放热反应,依据原电池原理可知必须是氧化还原反应;
①发生氧化反应的为负极,发生还原反应的为正极;
②依据电子转移守恒计算和分析两个电极变化;
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuS04溶液,锌将铜置换出来与锌形成原电池加快反应速率,所以反应快的为X,据此分析.
解答 解:(1)由图1为生成物能量大于反应物能量,则该反应为吸热反应,有化合价变化的是为氧化还原反应,则只有C为吸热的氧化还原反应,故选:C;
(2)设计原电池需要反应发生的是氧化还原反应,原电池的反应通常是放热反应,比较分析可知AD为非氧化还原反应,B为放热反应的氧化还原反应,C为吸热反应的氧化还原反应,所以B符合原电池设计原理的要求,故答案为:B.
①由原电池总反应Zn+H2SO4═ZnSO4+H2↑,其中负极材料是锌,发生氧化反应,溶液中氢离子得到电子在正极生成氢气,电极反应2H++2e-=H2↑,故答案为:锌;氧化;2H++2e-=H2↑;
②当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;正极上放出氢气,根据电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中bc正确;
故答案为:bc;
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuS04溶液,锌将铜置换出来与锌形成原电池加快反应速率,所以反应快的为X,则m曲线到达平衡的时间短,反应速率快,所以m曲线表示锌与稀硫酸X,故答案为:①X ②c.
点评 本题考查了原电池的设计、原理的分析和应用,主要是电极反应及其相关计算,电极产物判断,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | 溴水 | D. | BaCl2 |
| A. | 用醋酸钠晶体和碱石灰共热制甲烷 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯酚溶液中滴人少量稀溴水出现白色沉淀 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. | 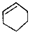 属于芳香族化合物 属于芳香族化合物 | B. | 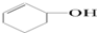 属于酚类化合物 属于酚类化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙烷 |
| A. | NH4+、Ca2+、HCO3-、NO3- | B. | Na+、Mg2+、NO3-、CH3COO- | ||
| C. | MnO4-、Na+、K+、SO42- | D. | SO42-、Cl-、K+、Ba2+ |