题目内容
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
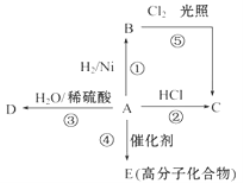
(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
【答案】乙醇 CH2=CH2+HCl![]() CH3CH2Cl 加成反应
CH3CH2Cl 加成反应 ![]() 加聚反应 溴水 ② 乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种
加聚反应 溴水 ② 乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种
【解析】
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯;在催化剂条件下,A反应生成高分子化合物E,则E是聚乙烯,乙烯和氯化氢发生加成反应生成C,C为氯乙烷;乙烯和氢气发生加成反应生成B,B为乙烷,B和氯气发生取代反应生成C(氯乙烷),反应①②③属于同种反应类型,则A和水发生加成反应生成D,D为乙醇,据此分析解答。
(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,结合上述分析,D为乙醇,故答案为:乙醇;
(2)反应②为一定条件下,乙烯和氯化氢发生加成反应生成氯乙烷,反应方程式为CH2=CH2+HCl![]() CH3CH2Cl,该反应属于加成反应;反应④为加热、催化剂条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为
CH3CH2Cl,该反应属于加成反应;反应④为加热、催化剂条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为![]() ,该反应属于加聚反应,故答案为:CH2=CH2+HCl
,该反应属于加聚反应,故答案为:CH2=CH2+HCl![]() CH3CH2Cl;加成反应;
CH3CH2Cl;加成反应;![]() ;加聚反应;
;加聚反应;
(3)除去乙烷中混有的少量乙烯,可以将混合气体通入溴水中洗气,故答案为:溴水;
(4)乙烷为饱和烃,与氯气在光照条件下发生取代反应,得到的产物除了氯乙烷外,还有: 1,1-二氯乙烷,1,2-二氯乙烷,1,1,2-三氯乙烷,1,1,2,2-四氯乙烷,1,1,1,2-四氯乙烷,1,1,1,2,2-五氯乙烷,六氯乙烷和氯化氢,产物不唯一;乙烯与HCl在催化作用下可发生加成反应,方程式为CH2=CH2+HCl![]() CH3CH2Cl,产物只有一种,因此制备氯乙烷的最好途径是反应②,故答案为:②;乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种。
CH3CH2Cl,产物只有一种,因此制备氯乙烷的最好途径是反应②,故答案为:②;乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷、二氯乙烷、三氯乙烷等多种取代产物,产物不唯一,而乙烯和氯化氢能发生加成反应得到氯乙烷,产物只有一种。

 阅读快车系列答案
阅读快车系列答案