��Ŀ����
����Ŀ����֪K��Ka��Kb��Kw��Kh��Ksp�ֱ��ʾ��ѧƽ�ⳣ��������ĵ���ƽ�ⳣ��������ĵ���ƽ�ⳣ����ˮ�����ӻ��������ε�ˮ��ƽ�ⳣ�������ܵ���ʵ��ܶȻ�������
��1���й�����������˵����ȷ����______��
a�����Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶�
b�����ǵĴ�С�����¶ȵ����߶�����
c�������£�CH3COOH��ˮ�е�Ka�����ڱ���CH3COONa��Һ�е�Ka
d��һ���¶��£���CH3COONa��Һ�У�Kw��Ka��Kh
��2��25��ʱ����a mol��L��1�İ�ˮ��0.01 mol��L��1�������������������Һ��c(NH4+)��c(Cl��)������Һ��_____(����������������������)�ԣ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ���ƽ�ⳣ��Kb��____��
��3����¯�����з����ķ�Ӧ��FeO(s)��CO(g)![]() Fe(s)��CO2(g) ��H<0���÷�Ӧ��ƽ�ⳣ������ʽK��_____����֪1100 ��ʱ��K��0.25����ƽ��ʱCO��ת����Ϊ________���ڸ��¶��£�����ø�¯��c(CO2)��0.020 mol��L��1��c(CO)��0.1 mol��L��1�����ʱ��Ӧ��������(��)_____��(��)(����>����<����������)��
Fe(s)��CO2(g) ��H<0���÷�Ӧ��ƽ�ⳣ������ʽK��_____����֪1100 ��ʱ��K��0.25����ƽ��ʱCO��ת����Ϊ________���ڸ��¶��£�����ø�¯��c(CO2)��0.020 mol��L��1��c(CO)��0.1 mol��L��1�����ʱ��Ӧ��������(��)_____��(��)(����>����<����������)��
��4����֪������Fe(OH)3��Mg(OH)2��Ksp�ֱ�Ϊ8.0��10��38��1.0��10��11����Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��MgCl2�Ļ����Һ�м����Һ��ҪʹFe3����ȫ������Mg2����������Ӧ�õ�����ҺpH�ķ�Χ��______(��֪lg2��0.3)��
���𰸡�ad �� ![]()
![]() 20% > 3.3��pH<9
20% > 3.3��pH<9
��������
(1)ƽ�ⳣ��ֻ���¶��йأ������¶�ƽ�������ȷ����ƶ���
(2)���û����Һ��c(NH4+)=c(Cl-)�����ݵ���غ��c(OH-)�Tc(H+)�����������غ��c(NH3��H2O)=(0.5a-0.005)mol/L�����ݵ���غ��c(H+)=c(OH-)=10-7mol/L����Һ�����ԣ�NH3H2O�ĵ��볣��Kb=![]() ��
��
(3)���ݻ�ѧ����ʽ��ƽ�ⳣ��������д����ʽ������ʼʱCO��Ũ��Ϊ1mol/L��
FeO(s)��CO(g)![]() Fe(s)��CO2(g)
Fe(s)��CO2(g)
��ʼ���ʵ���Ũ��(mol/L) 1 0
�仯���ʵ���Ũ��(mol/L) c c
ƽ�����ʵ���Ũ��(mol/L) 1-c c
���ƽ�ⳣ���ı���ʽ����ƽ��ʱCO��Ũ�ȣ��ټ�����ת���ʣ�����Ũ���̼�����ƽ�ⳣ���ȽϷ�����Ӧ���еķ���
(4)�ֱ����Fe3+��ȫ����ʱ��pH��Mg2+��ʼ����ʱ��pH��
(1)a��ƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ��������Ƕ��ܷ�ӳһ�������¶�Ӧ�仯���еij̶ȣ���a��ȷ��
b�������¶�ƽ�������ȷ����ƶ��������ѧƽ������Ӧ�Ƿ��ȷ�Ӧ���������¶Ȼ�ѧƽ�ⳣ��K��С����b����
c������ƽ�ⳣ��ֻ���¶��йأ��¶���ͬ����ƽ�ⳣ����ͬ����c����
d��һ���¶��£���CH3COONa��Һ��Ka=![]() ��Kh=
��Kh=![]() ��Kw=c��H+����c��OH-������Kw=KaKh����d��ȷ��
��Kw=c��H+����c��OH-������Kw=KaKh����d��ȷ��
��ѡad��
(2)���û����Һ��c(NH4+)=c(Cl-)�����ݵ���غ��c(OH-)�Tc(H+)����Һ�����ԣ����������غ��c(NH3��H2O)=(0.5a-0.005)mol/L�����ݵ���غ��c(H+)=c(OH-)=10-7mol/L����Һ�����ԣ�NH3H2O�ĵ��볣��Kb=![]() =
=![]() =
=![]() ��
��
(3)FeO(s)+CO(g)�TFe(s)+CO2(g)��H��0��ƽ�ⳣ����������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ���ƽ��Ũ���ݴη��˻���ƽ�ⳣ��K=![]() ������ʼʱCO��Ũ��Ϊ1mol/L��
������ʼʱCO��Ũ��Ϊ1mol/L��
FeO(s)��CO(g)![]() Fe(s)��CO2(g)
Fe(s)��CO2(g)
��ʼ���ʵ���Ũ��(mol/L) 1 0
�仯���ʵ���Ũ��(mol/L) c c
ƽ�����ʵ���Ũ��(mol/L) 1-c c
��ƽ�ⳣ��K=![]() =
=![]() =0.25����ã�c=0.2mol/L��CO��ת����Ϊ
=0.25����ã�c=0.2mol/L��CO��ת����Ϊ![]() =20%����֪1100��ʱ��K=0.25����ø�¯��c(CO2)��0.020 mol��L��1��c(CO)��0.1 mol��L��1��Ũ����Qc=
=20%����֪1100��ʱ��K=0.25����ø�¯��c(CO2)��0.020 mol��L��1��c(CO)��0.1 mol��L��1��Ũ����Qc=![]() =0.2��K������������¸÷�Ӧδ����ƽ��״̬����Ӧ������У������������� ��
=0.2��K������������¸÷�Ӧδ����ƽ��״̬����Ӧ������У������������� ��
(4)Fe3+��ȫ����ʱ��Һ��c��OH-��=![]() =2��10-11mol/L��c��H+��=5��10-4mol/L����ʱ��Һ��pH=-lgc(H+)=4-lg5=3.3��Mg2+��ʼ����ʱ��Һ��c��OH-��=
=2��10-11mol/L��c��H+��=5��10-4mol/L����ʱ��Һ��pH=-lgc(H+)=4-lg5=3.3��Mg2+��ʼ����ʱ��Һ��c��OH-��=![]() =1��10-5mol/L��c��H+��=1��10-9mol/L����ʱ��Һ��pH=9��ҪʹFe3����ȫ������Mg2����������Ӧ�õ�����Һ��pH��ΧΪ3.3��pH��9��
=1��10-5mol/L��c��H+��=1��10-9mol/L����ʱ��Һ��pH=9��ҪʹFe3����ȫ������Mg2����������Ӧ�õ�����Һ��pH��ΧΪ3.3��pH��9��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O��������ͼ��
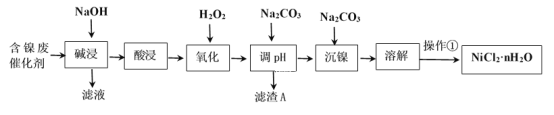
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Al��ԭ�ӽṹʾ��ͼΪ___��
��2��������������ܽ�����ʹ�õ���Ϊ___���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��____��
��3��������������H2O2��Һ����������___(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����___Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
��5���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��