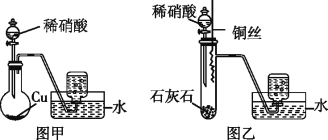
��Ŀ����
����Ŀ��ͭ���������緢�ֲ��㷺ʹ�õ�һ�ֽ�����������ͭ��Һ����εμ�ϡ��ˮ��������ɫ�����������μ�ϡ��ˮ�������ܽ⣬��Һ���ձ�Ϊ����ɫ����������ɫ��Һ�м�����ˮ�Ҵ�������[Cu(NH3)4]SO4��H2O���ش��������⣺
(1)��̬Cuԭ���У������ں����Ų���ԭ�ӹ������________����
(2)N��O��SԪ�ص�ԭ�ӶԼ��ϵ���������������_________��
(3)�Ҵ�������Cԭ�ӵ��ӻ���ʽ��_________
(4)[Cu(NH3)4]2+�У��ṩ�¶Ե��ӵ���________,Cu(NH3)2Cl2������ͬ���칹�壬����һ�ֿ�����ˮ������ֻ�������_______(���������������Ǽ�����)���ӣ��ɴ���֪[Cu(NH3)4]2+�Ŀռ乹����_________��
(5)��Ԫ�ض�Ӧ�ĺ�����������H2SO4
ǿ��H2SO3����ԭ��Ϊ___________________��
(6)ͭ��һ�������ᄃ��ṹ��ͼ��ʾ��
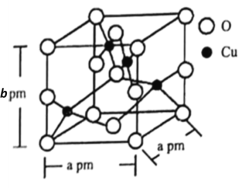
��������Ļ�ѧʽ��________�����þ���ṹΪ�����壬�������ͼ�������ӵ�����ΪNA�������������ܶ�Ϊ_______g��cm��3��
���𰸡�15 O sp3 NH3 ���� ƽ�������� H2SO4��H2SO3�ֱ�ɱ�ʾΪ(HO)2SO2�ͣ�HO��2SO��ǰ�߷��ǻ�����2�������ں��ߵķ��ǻ�����1��������Ŀ��ʹH2SO4�е�S-O-H��O�ĵ��Ӹ�ƫ����S��Խ�������H+�����Ը�ǿ CuO ![]()
��������
��1��ͭ��29��Ԫ�أ�������ӵ��Ų�Ϊ1s22s22p63s23p63d104s1��s�ܼ�һ�������p�ܼ�3�������d�ܼ�5�������ԭ�ӹ����15�������
��2��ԭ�ӶԼ��ϵ���������ȡ����Ԫ��ԭ�ӵĵ縺�Դ�С������Ԫ�ص縺�Ե������ڱ��еĹ��ɣ�ͬһ���ڣ��������ң��縺����ǿ��ͬһ���壬���ϵ��£��縺�Լ�������N��O��S���У��縺����ǿ����O�����ԶԼ��ϵ���������������O��
��3���Ҵ�������Cԭ�Ӷ��γ�4���������µ��Ӷԣ��ӻ���ʽ��sp3��
��4��[Cu��NH��4]2+�У�ͭ�����ṩ�չ�������������еĵ�Ԫ���ṩ�µ��Ӷԣ�Cu��NH3��2Cl2��ͬ���칹�������ˮ��������������ԭ����ˮ�Ǽ��Է��ӣ����Ը÷���Ӧ��Ϊ���Է��ӣ���Ȼ��������ͬ���칹�壬����[Cu��NH��4]2+�Ŀռ乹��Ӧ����ƽ���ı��Σ�
��5����Ԫ�ض�Ӧ�ĺ�����������H2SO4ǿ��H2SO3����ԭ��ΪH2SO4��H2SO3�ֱ�ɱ�ʾΪ(HO)2SO2�ͣ�HO��2SO��ǰ�߷��ǻ�����2�������ں��ߵķ��ǻ�����1��������Ŀ��ʹH2SO4�е�S-O-H��O�ĵ��Ӹ�ƫ����S��Խ�������H+�����Ը�ǿ��
��6����ͼ��ʾ�����ݾ�̯�����Լ����Cuȫ�������ڣ�4����O�ڶ��㡢���ϡ����Ϻ����ģ���8��![]() +2��
+2��![]() +4��
+4��![]() +1=4������ͭ���������������Ϊ1��1�����Ի�ѧʽΪCuO�������ܶ���=
+1=4������ͭ���������������Ϊ1��1�����Ի�ѧʽΪCuO�������ܶ���=![]() =
=![]() ��
��

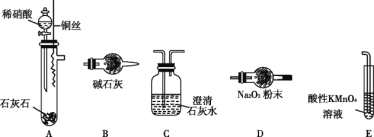
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | KMnO4 | Cl2 | NaOH��Һ |
A.AB.BC.CD.D