��Ŀ����
����Ŀ����1��Ԫ�صĵ�һ�����ܣ�Al____Si(����>������<��)�����縺���ɴ�С��˳������N��O��F___��
��2����̬Mn2+�ĺ�������Ų�ʽΪ___��
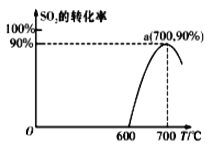
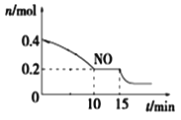
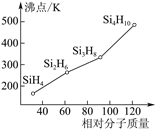
��3������(SinH2n+2)�ķе�������Է��������ı仯��ϵ��ͼ��ʾ���������ֱ仯��ϵ��ԭ����___��
��4����ɰ�Ǻ��ᾧˮ���������ƣ���������Xm-(��B��O��H����Ԫ��)�����ģ����ͼ��ʾ��
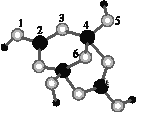
����Xm-�У���ԭ�ӹ�����ӻ�������___����λ��������___ԭ��֮��(��ԭ�ӵ����ֱ��)��
����ɰ������Na+��Xm-��H2O���ɣ�����֮����ڵ���������___(�����)��
A.���Ӽ� B.���ۼ� C.������ D.���»���E.���
���𰸡�< F��O��N 1s22s22p63s23p63d5(��[Ar]3d5) �������Է�������Խ���Ӽ䷶�»���Խǿ sp2��sp3 4��5(��5��4) ABDE
��������
(1)ͬ���ڴ����ҵ�һ���������������ƣ�����A�͵���A������ͬ����Ԫ�أ������ҵ縺����ǿ��
(2)Mn�ĵ����Ų�ʽΪ1s22s22p63s23p63d54s2��[Ar]3d54s2��
(3)�����Ƿ��Ӿ��壬�ṹ���ƣ���Է�������Խ���Ӽ�ķ��»���Խ�е�Խ�ߣ�
(4)��1��3��5��6������ԭ�ӣ�2��4����Bԭ�ӣ�2��B�γ�3��������Bԭ��Ϊsp2�ӻ���4��B�γ�4��������Bԭ��Ϊsp3�ӻ��� Bһ�����γ�3������4��B�γ�4����������1�����ܿ��ܾ�����λ������λ������4����5��֮�䣻
����������Xm-�γ����Ӽ���ˮ�����ɹ��ۼ��γɣ��ᾧˮ���Ӽ��������ͷ��»�����
(1)ͬ���ڴ����ҵ�һ���������������ƣ�����A�͵���A�������������ĵ�һ������С�ڹ�ģ�ͬ����Ԫ�أ������ҵ縺����ǿ��N��O��F�縺���ɴ�С��˳����F��O��N ���ʴ�Ϊ������F��O��N ��
(2)Mn�ĵ����Ų�ʽΪ1s22s22p63s23p63d54s2��[Ar]3d54s2�����̬Mn2+�ĺ�������Ų�ʽΪ1s22s22p63s23p63d5��[Ar]3d5���ʴ�Ϊ��1s22s22p63s23p63d5(��[Ar]3d5)��
(3)�����Ƿ��Ӿ��壬�ṹ���ƣ���Է�������Խ���Ӽ�ķ��»���Խ�е�Խ�ߣ��ʴ�Ϊ���������Է�������Խ���Ӽ䷶�»���Խǿ��
(4)��1��3��5��6������ԭ�ӣ�2��4����Bԭ�ӣ�2��B�γ�3��������Bԭ��Ϊsp2�ӻ���4��B�γ�4��������Bԭ��Ϊsp3�ӻ��� Bһ�����γ�3������4��B�γ�4����������1�����ܿ��ܾ�����λ������λ������4����5��֮�䣬�ʴ�Ϊ��sp2��sp3��4��5(��5��4)��
����������Xm-�γ����Ӽ���ˮ�����ɹ��ۼ��γɣ��ᾧˮ���Ӽ��������ͷ��»������ʴ�Ϊ��ABDE��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O��������ͼ��
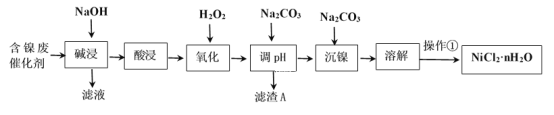
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Al��ԭ�ӽṹʾ��ͼΪ___��
��2��������������ܽ�����ʹ�õ���Ϊ___���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��____��
��3��������������H2O2��Һ����������___(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����___Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
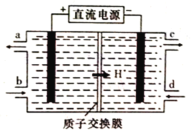
��5���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��