题目内容
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物。某学习小组欲探究其分解产物。
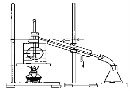
I.甲组同学设计了如下实验装置。

(1)实验中,装置B中观察到的现象是____________________。
(2)碱石灰的主要作用是__________________。
(3)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有_____________(写化学式)。
(4)设计实验验证装置A中固体残留物不含FeO:___________________(简要说明实验操作、现象和结论)。
Ⅱ.乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和下列所示装置进行实验。

(5)乙组同学的实验装置中,依次连接的合理顺序为A、__________。装置G中盐酸的作用是_________________。
(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),写出摩尔盐受热分解的化学方程式:___________________。(分解产物被充分吸收,不考虑其损失)
【答案】(1)白色固体变为蓝色
(2)碱石灰能吸收酸性气体(3)NH3
(4)取少量A中残留物与试管中,加入适量稀硫酸,充分振荡使其完全溶解,在所得溶液中滴加高锰酸钾溶液,并振荡,无明显现象,则残留物中不含有FeO;
(5)G、E、F、H;吸收氨气、并排除二氧化硫的干扰
(6)![]()
【解析】
试题分析:(1)硫酸亚铁铵晶体的化学式为:(NH4)2Fe(SO4)26H2O,在500℃时隔绝空气加热完全分解,有水生成,所以装置B中观察到的现象是白色固体变为蓝色;(2)碱石灰能吸收酸性气体;(3)装置D中观察到酚酞溶液变红色,说明溶液呈碱性,由此可知摩尔盐分解的产物中有NH3;(4)根据亚铁离子的还原性,可以用高锰酸钾溶液检验,方法为:取少量A中残留物与试管中,加入适量稀硫酸,充分振荡使其完全溶解,在所得溶液中滴加高锰酸钾溶液,并振荡,若高锰酸钾溶液褪色,则残留物中含有FeO;若高锰酸钾溶液不褪色,则残留物中不含FeO;三氧化硫和氯化钡溶液反应生成硫酸钡沉淀,二氧化硫与氯化钡溶液不反应,二氧化硫能使品红溶液褪色,用品红检验二氧化硫;用氢氧化钠吸收二氧化硫,用排水法收集氮气,所以依次连接的合理顺序为A、G、E、F、H;装置G中盐酸的作用是吸收氨气、并排除二氧化硫生成沉淀;(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),7.8400 g摩尔盐的物质的量![]() =0.02mol;根据氮元素守恒,H中收集到0.005mol N2,则生成氨气的物质的量是0.01mol;G中生成白色沉淀的质量为3.4950 g,所以生成SO3的物质的量是0.015mol,根据硫元素守恒,生成二氧化硫的物质的量是0.04mol-0.015mol=0.025mol;根据电子守恒,生成0.025mol二氧化硫,生成0.005mol N2,生成氧化铁0.01mol;摩尔盐受热分解的化学方程式:
=0.02mol;根据氮元素守恒,H中收集到0.005mol N2,则生成氨气的物质的量是0.01mol;G中生成白色沉淀的质量为3.4950 g,所以生成SO3的物质的量是0.015mol,根据硫元素守恒,生成二氧化硫的物质的量是0.04mol-0.015mol=0.025mol;根据电子守恒,生成0.025mol二氧化硫,生成0.005mol N2,生成氧化铁0.01mol;摩尔盐受热分解的化学方程式:![]() 。
。