题目内容
【题目】在一个密闭容器(W)中,进行如下两个可逆反应:
①A(g)+2B(g) ![]() 3C(g)+D(s) △H1>0 ②xM(g)+N(g)
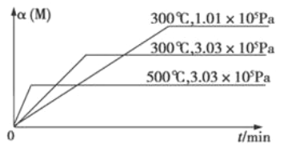
3C(g)+D(s) △H1>0 ②xM(g)+N(g) ![]() 3Q(g) △H2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。下列对W容器中进行的反应推断合理的是
3Q(g) △H2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则 v正(B): v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
【答案】B
【解析】
试题分析:Ⅰ、在某容器中进行反应②时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,结合反应特征和M的转化率变化分析判断,反应速率之比等于化学方程式计量数之比为正反应速率之比;Ⅱ、因为W容器中反应①是吸热反应,绝热容器中,反应①正向进行,温度降低反应②正向进行,平衡常数增大,所以反应②是放热反应;若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大。A、①△G>0,△H>0,高温下能自发,而反应②、①△G>0,△H<0,一定能自发,故A错误;B、在某容器中进行反应Ⅱ时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,图象变化可知温度相同,压强越大,M转化率越小,说明平衡逆向进行,逆向是气体体积减小的反应,x+1<3,x<2,化学方程式计量数为整数1,容器W内温度保持不变时反应达到平衡状态,C的正反应速率等于逆反应速率,反应速率之比等于化学方程式计量数之比为正反应速率之比,得到v正(B):v逆(C)═2:3,故B正确;C、若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大,故C错误;D、反应①是吸热反应,升高温度,平衡常数增大;反应②是放热反应,升高温度,平衡常数减小,故D错误;故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


