题目内容
【题目】(1)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图(左)所示:原电池工作过程中OH-的作用是_______________;负极电极反应式为:_____________。若电路中转移电子数为0.8NA,左侧溶液中pH________(填“增大”,“减小”,”不变”)(忽略溶液体积的变化),右侧的OH-物质的量变化量为_________。
(2)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=m kJ·mol—1
CO(g)+3H2(g) ΔH=m kJ·mol—1
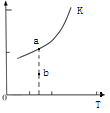
则反应的平衡常数表达式K=______________,K的大小与温度(T)的关系如上图(右)中曲线所示,则m__________0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率___________(填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将_______________(填“增大”、“减小”或“不变”)。
【答案】(1)参与电极反应,定向移动形成电流(各1分,共2分);
CH4-8e-+10OH-=CO3-+7H2O(2分);不变(1分);0.2mol(2分)
(2)![]() (2分);>(2分);不确定(2分);不变(2分)
(2分);>(2分);不确定(2分);不变(2分)
【解析】
试题分析:(1)甲烷失去电子转化为CO2,CO2结合氢氧根生成碳酸根,则氢氧根的作用是参与电极反应,定向移动形成电流;负极通入甲烷,电极反应式为CH4-8e-+10OH-=CO3-+7H2O;。若电路中转移电子数为0.8NA,正极消耗氧气是0.2mol,生成氢氧根是0.8mol,由于生成的氢氧根向负极移动,所以左侧溶液中pH不变”。根据负极电极反应式可知右侧甲烷消耗1mol氢氧根,所以右侧的OH-物质的量变化量为1mol-0.8mol=0.2mol。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知反应的平衡常数表达式K=
CO(g)+3H2(g)可知反应的平衡常数表达式K=![]() ,根据图像可知升高温度K增大,所以正反应是吸热反应,m>0;由于不能确定改变的条件,所以使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,不能确定CH4的转化率如何变化;焓变只与反应物和生成物总能量的相对大小有关系,所以△H不变。
,根据图像可知升高温度K增大,所以正反应是吸热反应,m>0;由于不能确定改变的条件,所以使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,不能确定CH4的转化率如何变化;焓变只与反应物和生成物总能量的相对大小有关系,所以△H不变。







