题目内容
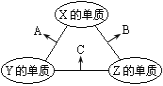
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


【答案】![]() 2:1 二氧化硫融入过多使溶液呈酸性,而
2:1 二氧化硫融入过多使溶液呈酸性,而![]() 可以与氢离子反应,导致产量降低 蒸发浓缩 冷却结晶 溶液由无色变为蓝色,且半分钟颜色不退去 18.10 89.28%
可以与氢离子反应,导致产量降低 蒸发浓缩 冷却结晶 溶液由无色变为蓝色,且半分钟颜色不退去 18.10 89.28%
【解析】
装置A为二氧化硫的发生装置,装置B为硫代硫酸钠的制备装置,装置C为尾气处理装置。
(1)A为二氧化硫的发生装置,反应的化学方程式为![]() ;
;
(2)装置B中发生的反应为![]() ,为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为2:1;
,为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为2:1;
(3)硫代硫酸钠在酸性条件下会发生水解,二氧化硫过量会使溶液呈酸性,导致产品产量减少,所以二氧化硫不能过量;
(4)过滤B中的混合物,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O35H2O晶体;
(5)①滴定所用指示剂是淀粉溶液,当达到滴定终点时,碘稍过量,碘遇淀粉变蓝色;所以溶液会由无色变为蓝色;
②由滴定管的读数可知,开始的刻度是0.50mL,后来的读数是18.60mL,所用溶液的体积是18.10mL,即x=18.10mL,实验序号1所得的体积与另外两组相差较大,舍去,则消耗标准液的平均体积为18.00mL,则碘的物质的量是0.0180L×0.1000mol/L,根据碘与硫代硫酸钠反应的方程式可知硫代硫酸钠的物质的量是0.0180L×0.1000mol/L×2×10=0.036mol,所以产品的纯度为![]() ×100%=89.28%。
×100%=89.28%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D