题目内容
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其消毒后被还原为Fe(OH)3;又可以有净水的功能,是一种无二次污染的绿色水处理剂。工业上制备方法有:①湿法:次氯酸盐氧化法②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为Fe(OH)3+KClO+KOH=K2FeO4+KCl+H2O,配平上述反应化学方程式___。
(2)干法制备中牵涉到的物质有:FeSO4、K2FeO4、K2SO4、K2O2,将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目___。
(3)制备相同质量 K2FeO4 时转移的电子数,湿法制备 ___干法制备(填“>” “<”或“=”)。
(4)高铁酸钾和二氧化氯(其还原产物为 Cl—)都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的___倍。
【答案】2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O ![]() < 0.2
< 0.2
【解析】
(1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,根据电子得失守恒及元素守恒配平化学方程式;
(2)干法制备中制备高铁酸钠(Na2FeO4),故由FeSO4反应得到,铁元素化合价升高,需要氧化剂,据此分析;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子;
(4)高铁酸钾和二氧化氯(ClO2)都是高效杀菌消毒剂,均表现氧化性,则消毒效率分别为:
K2FeO4~Fe3+~3e-
198g 3mol
1g![]() mol
mol
ClO2~Cl-~5e-
67.5g 5mol
1g ![]() mol,据此计算可得。
mol,据此计算可得。
(1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;
(2)干法制备中制备高铁酸钠(Na2FeO4),故由FeSO4反应得到,铁元素化合价升高,需要氧化剂,则为Na2O2,可得反应:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4,故作为反应物的物质为2FeSO4+4Na2O2,其中Fe2+失电子发生氧化反应,用单线桥标出电子转移的方向和数目为![]() ;
;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子,所以制备相同质量Na2FeO4时转移的电子数,湿法制备<干法制备;
(4)高铁酸钾和二氧化氯(ClO2)都是高效杀菌消毒剂,均表现氧化性,则消毒效率分别为:
K2FeO4~Fe3+~3e-
198g 3mol
1g![]() mol
mol
ClO2~Cl-~5e-
67.5g 5mol
1g ![]() mol
mol
则高铁酸钾的效率是二氧化氯的![]() mol:
mol:![]() mol =0.2。
mol =0.2。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
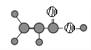
B | ①由C、H两种元素组成;②球棍模型为 |
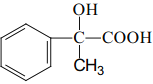
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
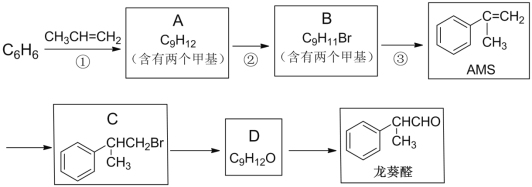
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类,它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式_____________。
(4)C与D反应能生成相对分子质量为100的酯,其化学方程式为________________。
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:

(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。