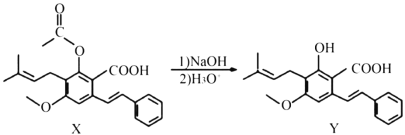
题目内容
【题目】回答下列关于铁元素及其化合物的知识:
(1)将 NaOH 溶液滴入 FeSO4溶液中,能观察到的现象是___,请写出产物颜色变化时发生的反应方程式___。
(2)实验室配制氯化铁溶液时,通常应将氯化铁固体溶解在加有少量 ___的水中; FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,其原因是___。(用离子方程式表示)
(3)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。该反应的化学方程式_________________,该反应中的还原剂是___,氧化剂是___。
(4)在 100mL18mol/L的浓硫酸中加入过量的铁片,加热使之充分反应,产生的气体在标准状况下的体积可能是 ___。
A.40.32L B.25.76L C.20.16L D.6.72L
【答案】先产生白色沉淀,并逐渐变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 浓盐酸 4Fe2++4H++O2=4Fe3++2H2O 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe H2O B
Fe3O4+4H2 Fe H2O B
【解析】
(1)硫酸亚铁和氢氧化钠发生反应生成氢氧化亚铁沉淀,易被氧化为氢氧化铁;
(2)氯化铁固体直接溶解在水中易水解,需要加入酸抑制铁离子水解;Fe2+在空气中易被氧化;
(3)铁与水蒸气在加热条件下发生氧化还原反应生成四氧化三铁和氢气;
(4)根据铁能和浓硫酸反应硫酸铁和二氧化硫,能和稀硫酸反应生成硫酸亚铁和氢气判断。
(1)硫酸亚铁和氢氧化钠发生反应生成氢氧化亚铁白色沉淀,该白色沉淀易被氧化为氢氧化铁红褐色沉淀,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(2)氯化铁固体溶解在较浓的盐酸中,可抑制铁离子水解,再加水稀释;Fe2+有较强的还原性,则FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,是Fe2+在空气中易被氧化为Fe3+的缘故,发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O;
(3)铁与水蒸气发生氧化还原反应:3Fe+4H2O(g)![]() Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;
Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;
(4)浓硫酸的物质的量为0.1L×18mol/L=1.8mol,若只发生2Fe+6H2SO4![]() Fe2(SO4)3+3SO2↑+6H2O,生成的SO2的物质的量应为0.9mol,则V(SO2)=0.9mol×22.4L/mol=20.16L;随着反应的进行,Fe和稀硫酸反应,若只发生Fe+H2SO4
Fe2(SO4)3+3SO2↑+6H2O,生成的SO2的物质的量应为0.9mol,则V(SO2)=0.9mol×22.4L/mol=20.16L;随着反应的进行,Fe和稀硫酸反应,若只发生Fe+H2SO4![]() FeSO4+H2↑,参加反应的硫酸为1.8mol,则生成的H2的物质的量为1.8mol,其体积V(H2)=1.8mol×22.4L/mol=40.32L,实际生成的气体体积应为二者之间,故答案为B。
FeSO4+H2↑,参加反应的硫酸为1.8mol,则生成的H2的物质的量为1.8mol,其体积V(H2)=1.8mol×22.4L/mol=40.32L,实际生成的气体体积应为二者之间,故答案为B。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案