题目内容
15.有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.(1)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.
请写出四种元素的元素符号:A:H B:O C:S D:Cl
将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为Fe+2Fe3+=3Fe2+.
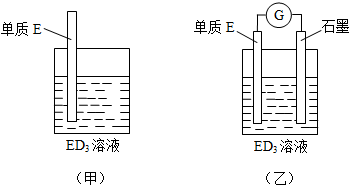
(2)依据(乙)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,单质E一极发生的反应可以表示为Fe-2e-=Fe2+,石墨一极发生的反应可以表示为2 Fe3++2e-=2Fe2+.
分析 有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(2)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+.
解答 解:有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)由上述分析可知,A为H,B为O,C为S、D为Cl;
金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:H;O;S;Cl;Fe+2Fe3+=3Fe2+;
(2)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,负极电极反应式为:Fe-2e-=Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+,正极电极反应式为:2Fe3++2e-=2Fe2+,
故答案为:Fe-2e-=Fe2+;2Fe3++2e-=2Fe2+.
点评 本题考查元素推断和电化学知识,题目难度不大,推断元素的种类为解答关键,注意理解掌握电极反应式的书写.

 阅读快车系列答案
阅读快车系列答案| A. | 在多电子的原子里,能量高的电子通常在离核远的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
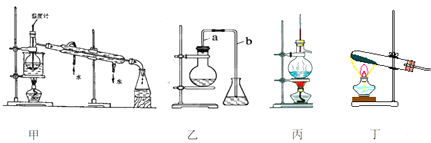
| A. | 装置甲:石油分馏 | B. | 装置乙:溴苯的制取 | ||
| C. | 装置丙:乙烯的制取 | D. | 装置丁:乙酸乙酯的制取 |
| A. | 微粒半径 | B. | 化学性质 | C. | 最外层电子数 | D. | 质子数 |
| A. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ/mol (△H代表乙醇的燃烧热) | |
| B. | HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H=-57.3kJ/mol (△H代表中和热) | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6 kJ/mol (反应热) | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol (反应热) |
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
 ③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3
③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3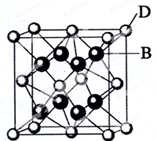 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答: 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应的反应热.