题目内容
20.下列热化学方程式书写正确的是(△H的绝对值均正确)( )| A. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ/mol (△H代表乙醇的燃烧热) | |
| B. | HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H=-57.3kJ/mol (△H代表中和热) | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6 kJ/mol (反应热) | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol (反应热) |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、中和热是强酸强碱稀溶液中和反应生成1mol水时放出的热量;
C、热化学方程式中标注物质聚集状态,标明反应放出或是吸收的热量;
D、固体碳燃烧时放出热量,焓变是负值.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应中生成的水为气体不是稳定氧化物,故A错误;
B、中和热是强酸强碱稀溶液中和反应生成1mol水时放出的热量,该热化学方程式符合题意,故B正确;
C、2H2O(g)=2H2(g)+O2(g)△H=+483.6 kJ/mol (反应热)表明了水的分解过程以及所吸收的热量两个方面,故C正确;
D、固体碳燃烧时放出热量,焓变是负值,不是吸热的反应,故D错误.
故选BC.
点评 本题考查了热化学方程式书写方法,主要是燃烧热、中和热的概念理解和判断,注意热化学方程式书写方法和原则,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.实验室中以下物质的贮存方法,不正确的是( )
| A. | 保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 少量液溴可用水封存,防止溴挥发 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
11.将18g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下2.24L NO,剩余9.6g金属;继续加入200mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A. | 原混合物中铜和铁各0.15 mol | |
| B. | 稀硝酸的物质的量浓度为1 mol•L-1 | |
| C. | 第一次剩余9.6 g金属为铜和铁 | |
| D. | 再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
8.下列气体中,无色无味的是( )
| A. | SO2 | B. | NO2 | C. | Cl2 | D. | CH4 |
12.下列有关化学用语表达不正确的是( )
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: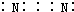 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
9.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
12.下列有关同系物、同分异构体的说法正确的是( )
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
 ,取代反应.
,取代反应.