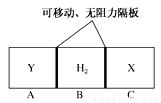
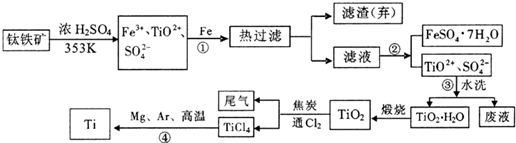
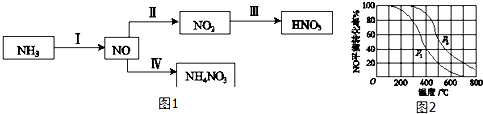
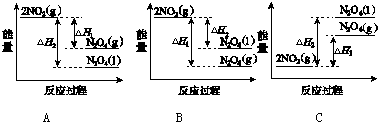
题目内容
15.实验中需用1.0mol•L-1的CuSO4溶液950mL,配制时选用容量瓶的规格和称取药品的质量分别为( )| A | B | C | D | |
| 容量瓶规格 | 1000mL | 950mL | 500mL | 1000mL |
| CuSO4质量 | 152g | 152g | 80g | 160g |
| A. | A | B. | B | C. | C | D. | D |
分析 一定容积规格的容量瓶只能配制相应体积的溶液,由于没有950ml的容量瓶,选择大于950ml相近规格的容量瓶;根据m=cVM计算所需CuSO4质量.
解答 解:由于没有950ml的容量瓶,选择大于950ml相近规格的容量瓶,所以应选择1000ml规格容量瓶,
所需CuSO4质量为1L×1mol/L×160g/mol=160.0g.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,注意没有950ml的容量瓶,溶液实际应配制1000ml,所用固体的质量应按配制1000mL溶液计算所用的量称量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.在一个固定体积的密闭容器中,加入2molA和1molB,发生反应 2A(g)+B(g)?2C(g),达到平衡时,C的物质的量浓度为K mol/L,若维持容器体积和温度不变,按下列配比作为起始物质.达到平衡后,C的物质的量浓度仍是K mol/L的是( )
| A. | 4molA+2molB | B. | 2molA+1molB+2molC | ||
| C. | 2molC+1molB | D. | 1molA+0.5molB+1molC |
20.水作为氧化剂的反应是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO3+H2O═H2SO4 | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 常温常压下,14g N2含有电子数为7NA | |
| D. | 等质量的CO与CO2中所含碳原子数之比为7﹕11 |
4.将0.5mol Cu2S与足量稀HNO3反应,生成Cu(NO3)2、S、NO和H2O.下列说法正确的是( )
| A. | Cu2S在反应中既是氧化剂又是还原剂 | |
| B. | 以上反应中转移电子的物质的量为1 mol | |
| C. | 以上参加反应的HNO3中被还原的HNO3为2 mol | |
| D. | 反应中,氧化剂和还原剂的物质的量之比为4:3 |