题目内容
3.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.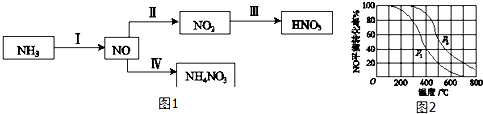
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)Ⅱ中,2NO(g)+O2(g)═2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图2).
①比较p1、p2的大小关系:p1<p2.
②随温度升高,该反应平衡常数变化的趋势是减小(填增大或减小).
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是A(选填字母).
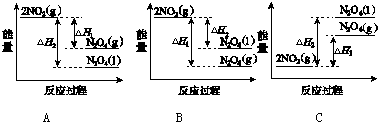
②N2O4与O2、H2O化合的化学方程式是2N2O4+O2+2H2O═4HNO3.
分析 (1)氨气与氧气在催化剂加热的条件下生成NO与水;
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,根据压强对平衡的影响分析;
②根据图象2判断该反应正方向是放热还是吸热,再判断K随温度的变化;
(3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)?N2O4(l)为放热反应,同种物质液态时能量比气态时能量低;
②N2O4与O2、H2O化合生成硝酸,根据得失电子守恒和原子守恒写出反应的方程式.
解答 解:(1)氨气与氧气在催化剂加热的条件下生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知p2时NO的转化率大,则p2时压强大,即p1<p2;故答案为:p1<p2;
②由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K减小;故答案为:减小;
(3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)?N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;故答案为:A;
②N2O4与O2、H2O化合生成硝酸,其反应的化学方程式为:2N2O4+O2+2H2O=4HNO3,故答案为:2N2O4+O2+2H2O=4HNO3.
点评 本题考查了化学方程式书写、影响平衡及平衡常数的因素、能量变化图的分析等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 汽车轮胎 | B. | 涤纶 | C. | 聚乙烯制品 | D. | 玻璃钢 |
| A. | 金属氧化物 氧化铁 FeO | B. | 非金属氧化物 二氧化硫 SO2 | ||
| C. | 碱性氧化物 过氧化钠 Na2O2 | D. | 碱 纯碱 Na2CO3 |
| A | B | C | D | |
| 容量瓶规格 | 1000mL | 950mL | 500mL | 1000mL |
| CuSO4质量 | 152g | 152g | 80g | 160g |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1Lmol.L-1的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) | |
| B. | 醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| C. | 将pH=5的H2SO4溶液稀释1×103倍后,c(H+):c(SO42-)=2:1 | |
| D. | 常温下,pH=4的NaHC2O4溶液中:c(C2O42-)<c(H2C2O4) |

