��Ŀ����
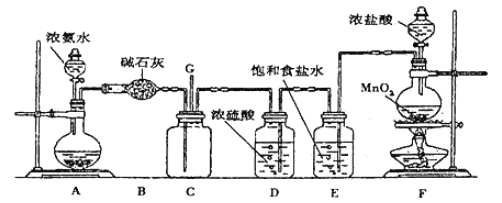
����Ŀ��������������Ӧ�����е������仯����ͼ��ʾ�������й�˵������ȷ����
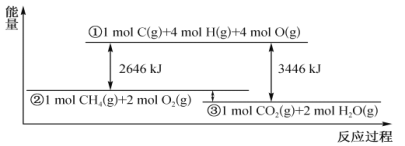
A. ��Ӧ CO2(g)+2H2O(l)==CH4(g)+2O2(g) ��H<0
B. ����1mol CO2(g)��2 molH2O(l)����������ͼ�У�����λ���ڢ١���֮��
C. ��CһH���ļ���Ϊ415kJ mol-1����O= O�ļ���Ϊ493 kJ mol-1
D. ���÷�Ӧ������ת���Ļ�ѧ��Ϊ200kJ������0.25 molC=O����
���𰸡�C
��������
A.�����ȼ�շ�Ӧ�Ƿ��ȷ�Ӧ�����CO2(g)+2H2O(l)==CH4(g)+2O2(g) ��H��0����A����
B.Һ̬ˮ������������������̬ˮ�����������������ڢ۵��·�����B����
C.��ͼ���֪�ƻ�4mol C-H����2molO-O������Ҫ����2646kJ�����������ƻ�4mol C-H����Ҫ����4��415kJ=1660kJ�����������ƻ�1mol�����е� O=O�еĻ�ѧ����Ҫ���յ�����Ϊ![]() (2646-1660)kJ=493kJ����C��ȷ��
(2646-1660)kJ=493kJ����C��ȷ��
D.������֮��=������������-��Ӧ������������1mol CH4 (g)��2mol O2(g)��������֮��Ϊ(3446-2646)=800kJ��1molCH4 ���뷴Ӧ�ų�800kJ���������������仯Ϊ200kJʱ������뷴Ӧ��CH4 0.25mol����Ԫ���غ㣬������0.25molCO2��CO2�ṹ��ʽΪO=C=O������0.5molO=C�����ɣ���D����
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ������Ҵ���ˮ�Ʊ����漰��Ӧ���£�
��2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) ��H1=��23.9 kJmol-1
CH3OCH3(g)+ H2O(g) ��H1=��23.9 kJmol-1
��2CH3OH(g)![]() C2H4(g)+2H2O(g) ��H2= ��29.1kJmol-1
C2H4(g)+2H2O(g) ��H2= ��29.1kJmol-1
��CH3CH2OH(g)![]() CH3OCH3(g) ��H3= +50.7kJmol-1
CH3OCH3(g) ��H3= +50.7kJmol-1
��C2H5OH(g)![]() C2H4(g)+ H2O(g) ��H4=akJmol-1
C2H4(g)+ H2O(g) ��H4=akJmol-1
�ش��������⣺
(1)a=___________��
(2)��1.0L�ܱ������з���0.10 mol C2H5OH(g)����һ���¶��½��Тܷ�Ӧ����Ӧʱ��(t)��������������ѹǿ(P)�����ݼ��±���
ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
��ѹǿP/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
�������C2H5OH��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ___________(����ĸ)��
a.�����¶� b.����ѹǿ
c.ͨ���Ҵ� d.����ѹǿ
������ѹǿP����ʼѹǿP0���㷴Ӧ��C2H5OH��ת����(C2H5OH)�ı���ʽΪ_________��ƽ��ʱC2H5OH��ת����Ϊ_______(���������λ��Ч���֣���ͬ)���÷�Ӧ��ƽ�ⳣ��K=_________��
������ѹǿP����ʼѹǿP0��ʾ��Ӧ��ϵ�������ʵ���n(��)�ͷ�Ӧ��C2H5OH���� �ʵ���n(C2H5OH)��n(��)=_____mol��n(C2H5OH)=_____mol��
(3)�±�Ϊ��Ӧ���з�Ӧ��Ũ���뷴Ӧʱ������ݣ������÷�Ӧ��c(C2H5OH)�仯��ʱ����(��t)�Ĺ��ɣ��ó��Ľ�����______���ɴ˹����Ƴ���Ӧ��12hʱc(C2H5OH)����______molL-1
��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
����Ŀ�����ڷ�Ӧ��2SO2��O2![]() 2SO3(g)����������������ʱ��ֻ�ı�һ����Ӧ������������SO3�ķ�Ӧ���ʵı仯�����±��ո���(��������������С������������)��
2SO3(g)����������������ʱ��ֻ�ı�һ����Ӧ������������SO3�ķ�Ӧ���ʵı仯�����±��ո���(��������������С������������)��
��� | �ı������ | ����SO3���� |
�� | �����¶� | ________ |
�� | �����¶� | ________ |
�� | ��������Ũ�� | ________ |
�� | ʹ�ô��� | ________ |
�� | ѹ����� | ________ |