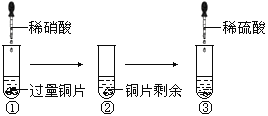
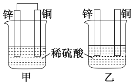
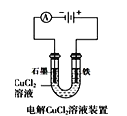
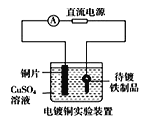
题目内容
【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。
【答案】碱金属 17 ⅣA NH3或NH4+ NH2- 第二周期第ⅥA族 光导纤维 ![]() 2HNO3+Na2SiO3=2NaNO3+H2SiO3↓
2HNO3+Na2SiO3=2NaNO3+H2SiO3↓ 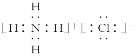
【解析】
(1)结合元素周期表结构及元素在元素周期表中的排布进行分析解答;
(2)由题干信息,A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),A元素有一种核素质量数为1,则A为H元素,B在常温下的单质为双原子分子,其氢化物水溶液呈碱性,则B为N元素,D原子的次外层电子数是最外层电子数的两倍,则D为Si元素,在周期表中B和C,C和E分别相邻,则C为O元素,E为S元素,B、E、G的最外层电子数之和为12,则G的最外层电子数为12-6-5=1,则G为K元素,则F为Cl元素,据此分析解答。
(1)元素周期表共有七个周期16个族,第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为碱金属元素,卤族元素位于第ⅦA族,为元素周期表的第17纵行,最高正价与最低负价的绝对值相等的元素位于第ⅣA族,故答案为:碱金属;17;ⅣA;
(2)根据上述分析可知,A为H元素,B为N元素,C为O元素,D为Si元素,E为S元素,F为Cl元素,G为K元素;
①有H元素和N元素形成的核外电子总数为10e-的微粒有NH3、NH4+、NH2-,故答案为:NH3或NH4+;NH2-;
②C为O元素,是8号元素,位于元素周期表的第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
③O元素和Si元素形成的化合物为二氧化硅,是光导纤维的主要材料,故答案为:光导纤维;
④S元素和K元素形成的化合物为K2S,是离子化合物,其形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]() ;
;
⑤2HNO3+Na2SiO3=2NaNO3+H2SiO3↓可说明酸性HNO3>H2SiO3,HNO3、H2SiO3分别为N、Si的最高价含氧酸,因此非金属性N>Si,故答案为:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓;
⑥H、N、Cl形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,则该化合物为NH4Cl,NH4Cl为离子化合物,电子式为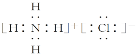 ,故答案为:
,故答案为: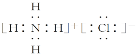 。
。

【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |